с чем взаимодействуют несолеобразующие оксиды
Химия, Биология, подготовка к ГИА и ЕГЭ
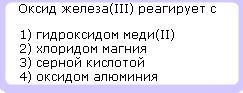
Вопрос А10 ГИА (ОГЭ) по химии —
Химические свойства оксидов: основных, амфотерных, кислотных
Классификация оксидов:
Оксиды, образованные металлами
Оксиды, образованные неметаллами
Основные
Кислотные
Несолеобразующие
— Na2O, CaO;
оксиды d-элементов в низших с.о. — CrO, FeO
d-элементы в средней с.о. — Cr2O3, Fe2O3, MnO2
1) оксиды неметаллов в высших и средних степенях окисления
CO2, N2O3, N2O5, SO3, SO2
2) оксиды d-элементов в высшей с.о.:
оксиды неметаллов в промежуточных степенях окисления:
Химические свойства основных оксидов:
Основные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами.
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щелочей:
1. Окисление кислородом:
если металл — d-элемент и «ему есть до чего окисляться»: 2FeO + O2 = Fe2O3
2. Взаимодействие с неметаллами:
2Na2O + S = 4Na + SO2
Fe2O3 + C = 2FeO + CO
3. Восстановление — реакции с водородом:
4. Образование солей с кислотными оксидами:
CaO + CO2 = CaCO3 (соль)
5. Взаимодействие с кислотами:
BaO + 2HNO3 = Ba(NO3)2 (соль) + H2O
Химические свойства амофтерных оксидов:
Амфотерные оксиды — это сложные химические вещества, также относящиеся к окислам, которые образуют соли
при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами).
1. Взаимодействие в растворе(!) с щелочами:
Al2O3 + 2H2O + 2NaOH = 2Na[Al(OH)4] + 3H2
2. Образование солей с кислотами:
ZnO + H2SO4 = ZnSO4 + H2O
Химические свойства кислотных оксидов:
Кислотные оксиды — это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Реакция с водой: образование кислот:
1. + O2
если элемент, образующий оксид в средней с.о.:
2. + H2
восстановление до несолеобразующего оксида или простого вещества:
3. + вещества. образованные металлами:
SO2 + CaO = CaSO3 (соль)
SO2 + 2LiOH = Li2SO3 + H2O
Химические свойства несолеобразующих оксидов
здесь все просто — они только
окисляются до кислотных и восстанавливаются до простых веществ:
Уроки по неорганической химии для подготовки к ЕГЭ
Свойства простых веществ:
Свойства сложных веществ:
Особенности протекания реакций:
Химические свойства оксидов
Взаимодействие оксидов с водой
Реакция идет, если образуется растворимое основание, а также Ca(OH)2:
Li2O + H2O → 2LiOH
Na2O + H2O → 2NaOH
K2O + H2O → 2KOH
MgO + H2O → Реакция не идет, ак как Mg(OH)2 нерастворим*
FeO + H2O → Реакция не идет, так как Fe(OH)2 нерастворим
CrO + H2O → Реакция не идет, так как Cr(OH)2 нерастворим
CuO + H2O → Реакция не идет, так как Cu(OH)2 нерастворим
SiO2 + H2O → реакция не идет
* Источник: [2] «Я сдам ЕГЭ. Курс самоподготовки», стр. 143.
Взаимодействие оксидов друг с другом
1. Оксиды одного типа друг с другом не взаимодействуют:
Na2O + CaO → реакция не идет
CO2 + SO3 → реакция не идет
2. Как правило, оксиды разных типов взаимодействуют друг с другом (исключения: CO2, SO2, о них подробнее ниже):
Взаимодействие оксидов с кислотами
1. Как правило, основные и амфотерные оксиды взаимодействуют с кислотами:
Исключением является очень слабая нерастворимая (мета)кремниевая кислота H2SiO3. Она реагирует только с щелочами и оксидами щелочных и щелочноземельных металлов.
CuO + H2SiO3 → реакция не идет.
2. Кислотные оксиды не вступают в реакции ионного обмена с кислотами, но возможны некоторые окислительно-восстановительные реакции:
С кислотами-окислителями (только если оксид можно окислить):
SO2 + HNO3 + H2O → H2SO4 + NO
Взаимодействие оксидов с основаниями
1. Основные оксиды с щелочами и нерастворимыми основаниями НЕ взаимодействуют.
2. Кислотные оксиды взаимодействуют с основаниями с образованием солей:
3. Амфотерные оксиды взаимодействуют с щелочами (т.е. только с растворимыми основаниями) с образованием солей или комплексных соединений:
а) Реакциях с растворами щелочей:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
б) Сплавление с твердыми щелочами:
Взаимодействие оксидов с солями
1. Кислотные и амфотерные оксиды взаимодействуют с солями при условии выделения более летучего оксида, например, с карбонатами или сульфитами все реакции протекают при нагревании:
Если оба оксида являются газообразными, то выделяется тот, который соответствует более слабой кислоте:
K2CO3 + SO2 → K2SO3 + CO2 (H2CO3 слабее и менее устойчива, чем H2SO3)
2. Растворенный в воде CO2 растворяет нерастворимые в воде карбонаты (с образованием растворимых в воде гидрокарбонатов):
CO2 + H2O + CaCO3 → Ca(HCO3)2
CO2 + H2O + MgCO3 → Mg(HCO3)2
В тестовых заданиях такие реакции могут быть записаны как:
MgCO3 + CO2 (р-р), т.е. используется раствор с углекислым газом и, следовательно, в реакцию необходимо добавить воду.
Это один из способов получения кислых солей.
Восстановление слабых металлов и металлов средней активности из их оксидов возможно с помощью водорода, углерода, угарного газа или более активного металла (все реакции проводятся при нагревании):
1. Реакции с CO, C и H2:
CuO + C → Cu + CO
CuO + CO → Cu + CO2
CuO + H2 → Cu + H2O
ZnO + C → Zn + CO
ZnO + CO → Zn + CO2
ZnO + H2 → Zn + H2O
PbO + C → Pb + CO
PbO + CО → Pb + CO2
PbO + H2 → Pb + H2O
FeO + C → Fe + CO
FeO + CО → Fe + CO2
FeO + H2 → Fe + H2O
2. Восстановление активных металлов (до Al включительно) приводит к образованию карбидов, а не свободного металла:
3. Восстановление более активным металлом:
4. Некоторые оксиды неметаллов также возможно восстановить до свободного неметалла:
Только оксиды азота и углерода реагируют с водородом:
В случае углерода восстановления до простого вещества не происходит:
CO + 2H2 CH3OH (t, p, kt)
Особенности свойств оксидов CO2 и SO2
1. Не реагируют с амфотерными гидроксидами:
CO2 + Al(OH)3 → реакция не идет
2. Реагируют с углеродом:
3. С сильными восстановителями SO2 проявляет свойства окислителя:
4. Сильные окислители окисляют SO2:
6. Оксид углерода (IV) CO2 проявляет менее выраженные окислительные свойства, реагируя только с активными металлами, например:
CO2 + 2Mg → 2MgO + C (t)
Особенности свойств оксидов азота (N2O5, NO2, NO, N2O)
1. Необходимо помнить, что все оксиды азота являются сильными окислителями. Совсем необязательно помнить какие продукты образуются в подобных реакциях, так как подобные вопросы возникают только в тестах. Нужно лишь знать основные восстановители, такие как C, CO, H2, HI и йодиды, H2S и сульфиды, металлы (и т.д.) и знать, что оксиды азота их с большой вероятностью окислят.
2. Могут окисляться сильными окислителями (кроме N2O5, так как степень окисления уже максимальная):
2NO + 3KClO + 2KOH → 2KNO3 + 3KCl + H2O
8NO + 3HClO4 + 4H2O → 8HNO3 + 3HCl
14NO + 6HBrO4 + 4H2O → 14HNO3 + 3Br2
NO + KMnO4 + H2SO4 → HNO3 + K2SO4 + MnSO4 + H2O
5N2O + 2KMnO4 + 3H2SO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O.
3. Несолеобразующие оксиды N2O и NO не реагируют ни с водой, ни с щелочами, ни с обычными кислотами (кислотами-неокислителями).
Химические свойства CO как сильного восстановителя
1. Реагирует с некоторыми неметаллами:
2. Реагирует с некоторыми сложными соединениями:
3. Восстанавливает некоторые металлы (средней и малой активности) и неметаллы из их оксидов:
3. С обычными кислотами и водой CO (также как и другие несолеобразующие оксиды) не реагирует.
Химические свойства SiO2
1. Взаимодействует с активными металлами:
SiO2 + 2Mg → 2MgO + Si
SiO2 + 2Ca → 2CaO + Si
SiO2 + 2Ba → 2BaO + Si
2. Взаимодействует с углеродом:
SiO2 + 2C → Si + 2CO
(Согласно пособию «Курс самоподготовки» Каверина, SiO2 + CO → реакция не идет)
3 С водородом SiO2 не взаимодействует.
4. Реакции с растворами или расплавами щелочей, с оксидами и карбонатами активных металлов:
SiO2 + Cu(OH)2 → реакция не идет (из оснований оксид кремния реагирует только с щелочами).
5. Из кислот SiO2 взаимодействует только с плавиковой кислотой:
Свойства оксида P2O5 как сильного водоотнимающего средства
Термическое разложение некоторых оксидов
В вариантах экзамена такое свойство оксидов не встречается, но рассмотрим его для полноты картины:
Основные:
4CuO → 2Cu2O + O2 (t)
2HgO → 2Hg + O2 (t)
Особенности оксидов NO2, ClO2 и Fe3O4
1. Диспропорционирование: оксидам NO2 и ClO2 соответствуют две кислоты, поэтому при взаимодействии с щелочами или карбонатами щелочных металлов образуются две соли: нитрат и нитрит соответствующего металла в случае NO2 и хлорат и хлорит в случае ClO2:
4NO2 + O2 + 2H2O → 4HNO3 (растворение в избытке кислорода)
2. Оксид железа (II,III) Fe3O4 (FeO·Fe2O3) содержит железо в двух степенях окисления: +2 и +3, поэтому в реакциях с кислотами образуются две соли:
Оксиды: классификация, получение и химические свойства
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
Железо также горит с образованием железной окалины — оксида железа (II, III):
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Химические свойства оксидов для ЕГЭ 2022
Классификация оксидов:
1 группа — несолеобразующие — N2O, NO, CO, SiO.
2 группа — солеобразующие:
Оксид углерода 2 и 4
Оксид углерода(II) в химическом отношении – инертное вещество. Не реагирует с водой, однако при нагревании с расплавленными щелочами образует соли муравьиной кислоты: CO + NaOH = HCOONa.
Взаимодействие с кислородом
При нагревании в кислороде сгорает красивым синим пламенем: 2СО + О2 = 2СО2.
Взаимодействие с водородом: СО + Н2 = С + Н2О.
Взаимодействие с другими неметаллами. При облучении и в присутствии катализатора взаимодействует с галогенами: СО + Cl2 = COCl2 (фосген). и серой СО + S = COS (карбонилсульфид).
СО – энергичный восстановитель. Восстанавливает многие металлы из их оксидов:
C +2 O + CuO = Сu + C +4 O2.
Взаимодействие с переходными металлами
С переходными металлами образует карбонилы:
Оксид углерода (IV) (углекислый газ, диоксид углерода, двуокись углерода,угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом. Химически оксид углерода (IV) инертен.
С сильными восстановителями при высоких температурах проявляет окислительные свойства. Углем восстанавливается до угарного газа: С + СО2 = 2СО.
Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа: 2Mg + CO2 = 2MgO + C.
Свойства кислотного оксида
Типичный кислотный оксид. Реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
Качественна реакция — для обнаружения углекислого газа является помутнение известковой воды:
В начале реакции образуется белый осадок, который исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат: CaCO3 + H2O + CO2 = Сa(HCO3)2.
Изучай химические свойства
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ