мезенхимальное образование что это
Мезенхимальное образование что это
Мезенхимома (ангиофибролипома, рабдомиофиброангиолипома, ангиолипосаркома, остеофибролипома и т. д.) опухоль сложного строения, состоящая из производных нескольких тканей мезенхимного происхождения. Впервые детально изучивший эту опухать G. Gilmour (1942) описал ее как новообразование, по своей структуре близкое к мезенхиме, с начальными признаками дифференцировки. Позже термин «мезенхимома» получил более широкое толкование и им стали обозначать опухали, в которых представлены разные производные мезенхимы, т е. являющиеся мезенхимальными тератомами.
В настоящее время многие склонны оба толкования выделять и объединять однокомпонентные мезенхимомы, строение которых близко к мезенхиме, и многокомпонентные или дифференцированные мезенхимомы, в состав которых входят несколько производных мезенхимы. Опухоли 2-й группы встречаются чаще.
Мезенхимома относится к редким опухолям. Локализуется преимущественно в толще мышц конечностей, особенно бедра (нередко параоссально), в забрюшииной клетчатке, на шее. Имеет форму узла. Может достигать большого размера, особенно при забрюшннной локализации. Макроскопически чаще всего определяют как фибролипому, фибролипоостеому и т. п. Обычно опухоль растет медленно, иногда же характеризуется быстрым ростом Склонна к рецидивам, может озлокачествляться. Микроструктура отличается пестротой беспорядочно перемешанные участки жировой, фиброзной, рыхлой соединительной, сосудистой тканей, островки кроветворения, островки хряща, кости, недифференцированная ткань типа мезенхимы. Последняя представлена полиморфными клетками — звездчатыми, веретенообразными, овальными, заключенными в аморфную миксоматозную основную субстанцию с небольшим количеством аргирофильных и коллагеновых волокон, сосудов капиллярного или синусоидного типа. Клетки образуют синцитий, реже — лежат изолированно. Местами в них намечается липобластическая дифференцировка.
Тканевые структуры в многокомпонентной мезенхиме аналогичны таковым в зрелых опухолях типа фибромы, липомы, лейомиомы и т. п. Нередко в них отмечают признаки катаплазии, и тогда в отдельных участках можно видеть структуры, близкие к фибросаркоме, полиморфно-клеточной липосаркоме и т. п. Костный компонент представлен как зрелыми обызвествленнымн балками, так иостеоидной тканью. Ангиоматозный компонент по структуре близок к капиллярной ангиоме, иногда также с элементами атипии. Озлокачествлению может подвергаться один или несколько компонентов опухоли, тогда образуется «смесь сарком».
Эпителиальные элементы в формировании мезенхимомы не участвуют. К мезенхимомам А. Р. Stont и R. Lattes (1967) причисляют и ангиомиолипомы почек, F. M. Enzinger и соавт из этой категории исключают мезодермальные смешанные опухоли урогеинтального тракта.
Опухоль встречается во всех возрастных группах, описаны врожденные у детей (до 20%). При локализации в почках мезенхимомы часто сочетаются с туберозным склерозом.
Рецидивы возможны и в морфологически доброкачественных опухолях. Последние первоначально четко отграничены, но в процессе роста возможно возникновение микроиифильтрации окружающих тканей, особенно частой при локализации в поперечноисчерченных мышцах. Такие опухоли должны расцениваться как «полузлокачественные».
Давать заключение на основании микроструктуры о возможности метастазирования следует осторожно.
Мезенхимальное образование что это
Эпителиально-мезенхимальный переход (Epithelial-mesenchymal transition, EMT) — сложный процесс изменения эпителиальными клетками эпителиального фенотипа на мезенхимальный, происходящий в эмбриональном развиитии, заживлении ран, а также при патологических процессах — например, при фиброзе, а также при опухолевой прогрессии.
Существует также и обратный процесс — мезенхимально-эпителиальный переход (Mesenchymal-epithelial transition).
Среди механизмов EMT можно выделить несколько ключевых моментов:
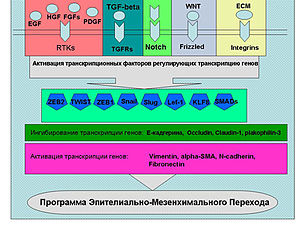
Растворимые факторы роста (на схеме), цитокины, молекулы внеклеточного матрикса активируют сигнальные пути ведущие к реализации программы ЭМП. Эти пути активируют ряд транскрипционных факторов (Snail, Twist, Slug, ZEB1, ZEB2, Lef-1 и др.), которые связываются с промоторами генов ответственных за ЭМП.
Одним из основных процессов, происходящих во время регенерации тканей является превращение эпителиальных клеток в мезенхимальные и наоборот, из мезенхимальных клеток в эпителиальные.
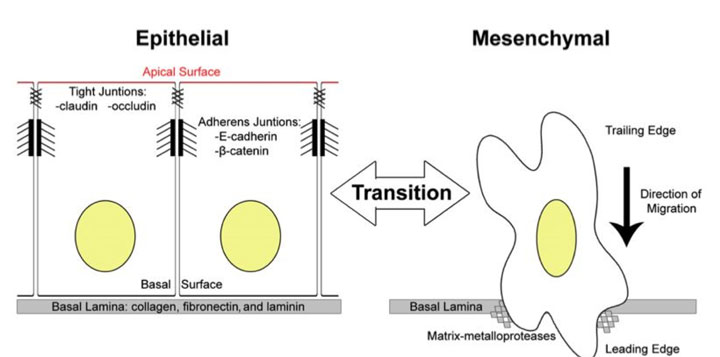
На рисунке выше показана разница между этими двумя основными фенотипами клеток. Важно, что нет никаких других многоклеточных тканей. Эпителиальные клетки плотно связаны друг с другом и с внеклеточным матриксом. Внеклеточный матрикс является базальной пластинкой, которая служит своего рода «колыбелью» для эпителиальных клеток. Мезенхимальные клетки расположены в 3D внеклеточной матрицы. Они биполярны, а это значит, что у них есть другое расположение цитоскелета и распределение органелл внутри них.
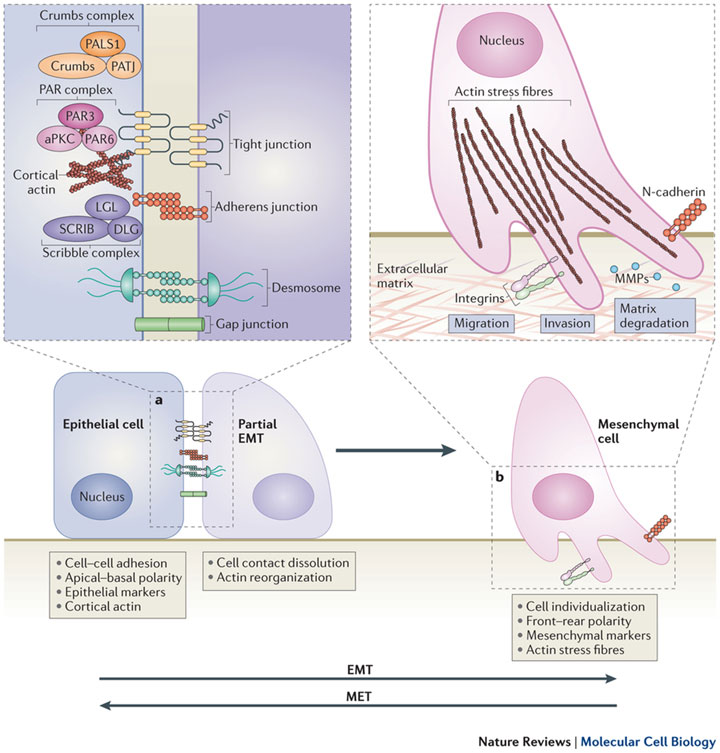
Утрата характерных черт эпителия (структуры ткани, клеточных взаимодействий, контроля специфическими факторами роста, приобретение подвижности и морфологии фибробластов) – это так называемое EMT, эпителиально-мезенхимальное превращение. ЕМТ свойственно нормальному эпителию в процессе развития, особенно раннего, например при гаструляции, когда эпителий приобретает подвижность и активно внедряется в подлежащие слои. ЕМТ имеет место при временных повреждениях ткани, при этом эпителиальные клетки теряют полярность, прекращают синтез кадхеринов, образуют виментин и фибронектин и одновременно с этим приобретают подвижность. Они прекращают синтез клеточных ядерных трансфакторов и образование антигенов, характерных для эпителиальных тканей. Эпителиальные клетки становятся типичными фибробластами. ЕМТ, по-видимому, лежит в основе инвазии и метастазирования: клетки эпителиальной опухоли становятся подвижными и приобретают способность расселяться по разным территориям организма. При этом очень существенно, что клетки претерпевают физиологическое, а не генетическое превращение, так как ЕМТ обратимо.
Метастазы, возникшие на основе ЕМТ, могут приобретать морфологию исходной опухоли, а эпителий в краевых районах раны может приобретать фибробластные свойства. Индукция ЕМТ имеет место при взаимодействии опухолей, экспрессирующих онкоген Ras и TGFр. Но так или иначе ЕМТ выглядит как заключительный этап прогрессии эпителиальной опухоли, когда опухоль теряет эпителиальные признаки (полярность клеток, специфические клеточные контакты, характерную морфологию и тканеспецифическую антигенную структуру) и одновременно приобретает черты фибробластов (экспрессию виментина, подвижность, независимость от территории роста).
Можно думать, что понимание этого процесса и факторов, в нем участвующих, создадут основу для рациональной терапии инвазии и метастазирования – главных свойств злокачественности. При этом непонятно, что будет дальше. Ведь прогрессия должна быть бесконечна, а EMT как бы завершает ее.
Источник: Nature Reviews Molecular Cell Biology 15,178–196, (2014)
Мезенхимальное образование что это
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ
Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ НМИЦ радиологии Минздрава России, Москва, Россия
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Гастроинтестинальные стромальные опухоли: классификация, диагностика и лечение
Журнал: Онкология. Журнал им. П.А. Герцена. 2013;2(2): 66-70
Вашакмадзе Л. А., Колобаев И. В., Беспалов П. Д., Степанов С. О., Кекеева Т. В. Гастроинтестинальные стромальные опухоли: классификация, диагностика и лечение. Онкология. Журнал им. П.А. Герцена. 2013;2(2):66-70.
Vashakmadze L A, Kolobaev I V, Bespalov P D, Stepanov S O, Kekeeva T V. Gastrointestinal stromal tumors: classification, diagnosis, and treatment. P.A. Herzen Journal of Oncology. 2013;2(2):66-70.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ
Гастроинтестинальные стромальные опухоли (GIST) являются наиболее распространенными мезенхимальными опухолями желудочно-кишечного тракта. Широкое внедрение молекулярной диагностики, а также появление препаратов таргетной терапии значительно изменили подходы к лечению и прогноз заболевания у больных с GIST. В обзоре представлены данные по истории вопроса, определению основных понятий, о различных методах инструментальной и лабораторной диагностики, вариантах лечения.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ
Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ НМИЦ радиологии Минздрава России, Москва, Россия
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Выделенные в самостоятельную нозологическую единицу гастроинтестинальные стромальные опухоли (англ. Gastrointestinal stromal tumors — GIST) уже не являются большой редкостью для онкологов. GIST — это стромальные опухоли желудочно-кишечного тракта (ЖКТ), которые имеют общее происхождение из одной клетки-предшественницы с интерстициальными клетками Кахаля. Последние расположены между циркулярными и продольными мышечными волокнами стенки органов ЖКТ и являются пейсмейкерами, регулирующими автономную перистальтическую активность. GIST являются наиболее распространенными новообразованиями в группе мезенхимальных опухолей ЖКТ.
GIST могут поражать любой отдел ЖКТ, но чаще всего локализуются в желудке (40—60%) и тонкой кишке (30—35%). Реже поражаются ободочная и прямая кишка (5—16%), крайне редко пищевод. Встречаются первичные GIST, локализующиеся вне полых органов, например, в сальнике или забрюшинном пространстве. Чаще GIST диагностируют у лиц среднего и пожилого возраста. Пик заболеваемости приходит на 5-й и 7-й десяток. Распределение по полу одинаковое, с незначительным преобладанием мужчин.
Алгоритм обследования больных с подозрением на GIST включает в себя эндоскопические и лучевые методы диагностики. Основным подтверждением диагноза является иммуногистохимическое исследование с определением специфических маркеров.
До недавнего времени единственным способом лечения GIST было оперативное вмешательство. Однако даже выполнение операции в объеме полной циторедукции не позволяло добиться 5-летней выживаемости выше 50—65%. В качестве адъювантного лечения пытались использовать системную химиотерапию, особенно у больных с диссеминированным процессом или у которых во время операции произошло нарушение целостности образования. Но реального улучшения выживаемости больных отмечено не было. Лучевая терапия применялась еще реже из-за малой эффективности, возможности лучевого повреждения кишечника и ограниченного применения только у больных с GIST желудка и прямой кишки. Медиана выживаемости больных с диссеминированным процессом составляла 10 мес.
Ситуация резко изменилась с 2001 г., когда группа финских онкологов под руководством Heikki Joensuu [1] сообщила о первом опыте применения ингибитора тирозинкиназного рецептора у больной с GIST. Они использовали препарат STI 571, который в настоящее время известен как гливек (иматиниб). Неэффективность традиционных схем химиотерапии и значительная противоопухолевая активность иматиниба послужили поводом для самой быстрой в современной истории регистрации препарата.
С этого момента началась новая эра в лечении больных с GIST. Тем не менее, несмотря на явное улучшение статистических показателей, нерешенных вопросов меньше не становится.
Таким образом, диагностика и лечение больных с GIST является актуальной проблемой современной онкологии.
Диагностика GIST
Эзофагогастродуоденоскопия в большинстве случаев позволяет предположить у больного наличие стромальной опухоли и, что немаловажно, выполнить биопсию образования. Эндоскопическая картина довольно разнообразна, размеры неэпителиальных образований варьируют от 1—2 см до 20—30 см. При небольшом размере опухоли и выполнении эндоскопического ультразвукового исследования (УЗИ) можно определить, что опухоль исходит из мышечного слоя [2]. Вместе с тем иногда при эндоскопической диагностике GIST возникают затруднения, которые связаны с особенностями роста опухоли. При небольшом размере опухолевого узла эндоскопическая картина может соответствовать, в зависимости от характера роста, неизменному органу (при экстраорганной форме), сдавлению извне (при смешанной форме) или подслизистому образованию — при эндоорганной форме. При первых двух формах редко удается точно оценить истинный размер опухолевого узла, даже с использованием эндосонографии. Слизистая оболочка на начальных этапах заболевания обычно не изменена, что сильно затрудняет щипцовую биопсию. Даже применение углубленной ступенчатой биопсии не всегда позволяет получить материал, пригодный для гистологического исследования [3, 4].
В такой ситуации простым и весьма эффективным методом является трансабдоминальное УЗИ с прицельной биопсией опухоли. Эхографическая картина GIST в типичном случае представляет собой единичные или множественные узловые образования, связанные со стенкой желудка или кишки. В наших наблюдениях в основном отмечалась внеорганная форма роста GIST. Контур образований на начальной стадии заболевания при размере узлов до 4 см ровный и четкий. На более поздних стадиях, в местах прорастания опухоли в прилежащие органы и брюшину, контур становится неровным и нечетким, что и является эхографическим признаком инвазивного роста. Структура опухолевых узлов солидная, средней эхогенности, с выраженной сосудистой сетью. Характерным для GIST является наличие в структуре опухоли жидкостных включений с ровной стенкой, с однородным анэхогенным содержимым. Полости могут быть различными, от единичных мелких до многосантиметровых, занимающих до 90% объема опухоли.
Для выполнения пункционной биопсии оптимальным является использование биопсийного пистолета, который оснащен одноразовыми съемными иглами. Наиболее подходящими по размеру являются иглы длиной 20 см и калибром 16—18G. При срабатывании биопсийного устройства происходит последовательный выброс с коротким (менее 0,1 с) интервалом внутренней, а затем внешней части иглы. При этом в пазе иглы задерживается фрагмент ткани в виде «столбика», длиной около 2 см и толщиной 1—1,5 мм. Данного количества материала, как правило, достаточно для проведения гистологического и иммуногистохимического исследования. Методика пункционной биопсии проводится следующим образом. После антисептической обработки кожи по предполагаемой трассе пункции раствором анестетика выполняется послойная инфильтрационная анестезия. Остроконечным скальпелем производится насечка на коже. Затем под постоянным экранным контролем биопсийная игла подводится к границе опухолевого образования и приводится в действие механизм биопсийного пистолета (см. рисунок). 
Таким образом, трансабдоминальное УЗИ с учетом ультразвуковой семиотики позволяет предположить GIST у обследуемого пациента, а также с высокой точностью оценить местную распространенность процесса. Прицельная пункция узлового образования в стенке полого органа с соблюдением описанных условий безопасна и позволяет получить материал для гистологического подтверждения диагноза на дооперационном этапе лечения.
Особое внимание в диагностическом алгоритме GIST уделяют компьютерной томографии (КТ), которая используется в качестве уточняющей диагностики, так как дает более четкое представление о размере, характере роста опухоли, инвазии соседних органов и структур, а также наличии метастазов. Не меньшее значение имеет использование КТ при проведении контрольного обследования больных после и в процессе лечения. На компьютерной томограмме GIST выглядят в виде одиночных или множественных объемных образований с неоднородной внутренней структурой и четкими контурами. Участки пониженной плотности в центральных отделах новообразований могут быть обусловлены внутриопухолевым некрозом, кровоизлиянием или кистозной дегенерацией. При внутривенном контрастировании отмечается выраженное неравномерное «усиление» опухолевых масс в ранние фазы исследования. В отличие от аденокарцином при гастроинтестинальных сторомальных опухолях не наблюдается концентрического сужения просвета пораженной кишки. Инвазии магистральных сосудов и венозного тромбоза, как правило, не отмечается. Несмотря на то что первичная опухоль гиперваскулярна, большинство внутрипеченочных метастазов выглядят как очаги пониженной плотности с признаками слабо выраженного контрастирования их периферических отделов в артериальную фазу. Однако у одного и того же пациента могут встречаться как гипо-, так и гиперваскулярные очаги. В наиболее крупных метастазах могут встречаться участки некроза, иногда зоны кровоизлияния и кальцинаты (последние, как правило, после химиотерапевтического лечения) [5].
С 1983 г., когда M. Mazur и H. Clark [6] впервые выделили особую подгруппу гастроинтестинальных неэпителиальных опухолей, отличающихся по своим иммуногистохимическим и ультраструктурным характеристикам от опухолей с истинной нейрогенной и гладкомышечной дифференцировкой и назвали их GIST, механизм возникновения этих опухолей долгое время оставался не ясен. Открытие S. Hirota и соавт. в 1998 г. [8] молекулярных механизмов, ответственных за появление GIST, позволило сделать значительный прорыв в понимании патогенеза данного заболевания. Было обнаружено, что для данного типа сарком характерны аномальная активация и гиперэкспрессия гена KIT (4q12), белковый продукт которого с-Kit (CD117, KIT) принадлежит к III типу семейства плазматических трансмембранных рецепторов тирозиновой киназы. Мутации в гене KIT встречаются в гастроинтестинальных опухолях у 56—92% больных [9]. Как правило, они локализованы в 9, 11, 13, 14 и 17-м экзонах гена.
В 3—8% наблюдений обнаруживают мутацию в гене PDGFRA (экзоны 12, 14 и 18), кодирующего α-рецептор тромбоцитарного фактора. Крайне редко мутации локализованы в гене BRAF (менее 1%). Приблизительно в 12—15% GIST выявить мутацию вышеуказанных генов не удается. В этом случае говорят о диком типе мутации [3, 5, 8, 10].
Маркер CD117 экспрессируется до 95% всех GIST. Другими маркерами, которые помогают иммунофенотипировать и дифференцировать GIST от других опухолей ЖКТ мезенхимального происхождения, являются: DOG1 (от англ. «discovered on GIST 1»), который определяется в 87% случаев, CD34 (рецептор кроветворных стволовых клеток и эндотелиоцитов) обнаруживают в 60—70% опухолей, гладкомышечный актин — в 30—40%. Некоторые опухоли экспрессируют S100 (5%), десмин (1—2%), общий кератин (1—2%) [3, 7, 10]. Необходимо отметить значение маркера пролиферативной активности Ki-67, уровень экспрессии которого достоверно повышается с ростом «риска агрессивности» GIST, что используют для оценки степени злокачественности и прогноза [11].
Согласно рекомендациям ведущих онкологических сообществ (ESMO, NCCN, Canadian Advisory Committee on GISTs и др.), диагноз GIST устанавливают на основании морфологического исследования биоптатов с обязательным проведением иммуногистохимического исследования на вышеуказанные маркеры. Вместе с тем NCCN и ESMO рекомендуют обязательное удаление стромальных опухолей размером 2 см и более, тогда как канадские эксперты считают, что все подозрительные на GIST образования должны быть удалены, даже если их размер не превышает 1 см, поскольку такие опухоли склонны к метастазированию [12—15].
В настоящее время накоплены факты, свидетельствующие, что опухоли с мутациями, локализованными в 11-м экзоне гена KIT, более чувствительны к таргетной терапии гливеком, чем опухоли, которые данных мутаций не имеют [9]. Опухоли с некоторыми мутациями в гене PDGFRА к гливеку резистентны. Таким образом, молекулярная диагностика GIST является важным прогностическим исследованием, которое позволяет судить о клиническом течении, предполагаемом ответе опухоли на препарат и стартовой химиотерапевтической дозе. Мутационный анализ не является обязательным, однако для уточнения прогноза заболевания и при назначении таргетной терапии эти данные крайне важны.
GIST не подлежат классификации TNM, для определения прогноза используются определения «риск развития рецидива заболевания» или «риск агрессивности опухоли». На протяжении последних 10 лет накоплен большой материал по данной нозологии. За это время проведено огромное количество исследований, в которых оценивалось влияние различных факторов на прогноз заболевания. В настоящее время основными предикторами являются размер и локализация опухоли, количество митозов на 50 полей зрения, характер мутации, а также наличие разрыва капсулы опухоли до или во время хирургического вмешательства.
Лечение. Резектабельные GIST
Хирургическое вмешательство в настоящее время остается основным методом лечения больных с локализованными и местно-распространенными формами GIST. При лечении стромальных опухолей ЖКТ необходимо строго придерживаться признаков онкологического радикализма [12—15]. Резекцию органов выполняют, отступив на 2 см от макроскопически определяемых краев новообразования. В отличие от раковых опухолей, выполнение лимфаденэктомии при GIST не показано, за исключением случаев, когда имеются явные признаки поражения лимфатических узлов. Это обусловлено тем, что частота лимфогенного метастазирования при стромальных опухолях не превышает 3%. Очень важно не допускать разрыва капсулы опухоли на этапах мобилизации и удаления, поскольку в этом случае прогноз заболевания становится сопоставимым с метастатическим формами GIST. Следует с осторожностью относиться к лапароскопическим вмешательствам при GIST большого размера в связи с высоким риском повреждения капсулы. Некоторые авторы рекомендуют принципиальное удаление большого сальника при всех стромальных опухолях ЖКТ.
Соблюдение принципов радикализма при хирургическом лечении локализованных и местно-распространенных GIST позволяет добиться общей 5-летней выживаемости у 54—65% больных (при условии полной циторедукции). При наличии остаточной опухоли (операции в объеме R1-R2) медиана выживаемости до внедрения таргетной терапии не превышала 12 мес [16—18].
Рецидивы и метастатические GIST
До недавнего времени лечение больных с рецидивными и метастатическими формами GIST представляло серьезную проблему в связи с крайне низкой чувствительностью стромальных опухолей ЖКТ к существующим цитостатикам и лучевой терапии. 5-летняя выживаемость при хирургическом лечении в объеме полной циторедукции опухоли составляла 35% [19]. Ситуация изменилась с внедрением в клиническую практику гливека, а позднее сутента (сунитиниб). В настоящее время ингибиторы тирозинкиназ являются золотым стандартом лечения рецидивных, нерезектабельных и метастатических форм GIST.
Дозы препарата и эффективность лечения напрямую зависят от типа мутации в гене KIT. Опухоли с мутациями в 11-м экзоне и некоторыми мутациями в 13-м экзоне отличаются высокой чувствительностью к таргетной терапии, поэтому лечение гливеком начинают с дозировки 400 мг/сут. При мутации в экзоне 9 начальную дозу увеличивают до 800 мг/сут, что обусловлено меньшей частотой объективного ответа и худшим прогнозом. При невозможности генетического типирования GIST лечение начинают с 400 мг, поскольку известно, что большинство стромальных опухолей имеют мутацию в 11-м экзоне (до 70%) [20, 21]. В случае прогрессирования заболевания на дозе 400 мг/сут рекомендован переход на 800 мг/сут [13—15, 22—27].
Опухоли с мутациями в 12-м и 18-м экзонах гена PDGFRА имеют повышенную чувствительность к иматинибу, за исключением мутации p.D842V, которая, напротив, свидетельствует о резистентности. На резистентность к гливеку также указывают вторичные мутации в 13-м и 17-м экзонах гена KIT, которые возникают вследствие приема препарата через некоторое время. Таким образом, при выборе схемы лечения необходимо учитывать тип мутаций в генах KIT и PDGFRA и генотипирование первичных опухолей, в частности с высоким риском метастазирования, для установления мутантных типов с первичной резистентностью к иматинибу. Анализ вторичных мутаций в GIST на фоне приема гливека может быть выполнен для мониторинга лекарственной резистентности.
В работах J. Gold и соавт. (2007) [4] и С. Blanke и соавт. (2008) [23] представлены результаты лечения больных с рецидивными и метастатическими формами GIST. В первом исследовании больные получали только хирургическое лечение. При этом общая 2-годичная выживаемость составила 41%, а медиана выживаемости — 19 мес. Во втором исследовании при сочетании хирургического лечения с адъювантной терапией гливеком аналогичные показатели составили 72—76% и 51—55 мес соответственно.
При дальнейшем прогрессировании заболевания на высоких дозах гливека либо при развитии неконтролируемых побочных эффектов показана вторая линия терапии. Препаратом выбора в данном случае является сутент — пероральный мультитаргетный тирозинкиназный ингибитор, обладающий противоопухолевой и антиангиогенной активностью [28—30]. Препарат доказал свою эффективность при приеме 50 мг/сут в течение 4 нед с последующим двухнедельным перерывом. По данным G. Demetri и соавт. [28], сутент увеличивал время до прогрессирования с 6,4 до 27,3 нед (р