макрофаги что к ним относится
МАКРОФАГИ
МАКРОФАГИ (греч, makros большой + phagos пожирающий) — клетки соединительной ткани, обладающие активной подвижностью, адгезивностью и выраженной способностью к фагоцитозу. Макрофаги открыты И. И. Мечниковым; он впервые установил их роль в защитных и других реакциях организма и предложил термин «макрофаги», подчеркивающий отличия этих клеток от клеток меньшего размера — «микрофагов» (т. е. сегментоядерных лейкоцитов, нейтрофилов), фагоцитирующих лишь мелкие чужеродные частицы, напр. микробы. Макрофаги описывали под разными названиями: клазматоциты Ранвье, рагиокринные клетки, адвентициальные клетки, блуждающие клетки в покое, пирроловые клетки, полибласты, амебоидные, металлофильные клетки, макрофагоциты, гистиоциты. Большинство этих терминов имеет лишь исторический интерес.
М., как и все клетки соединительной ткани, имеют мезенхимное происхождение, а в постнатальном онтогенезе дифференцируются из стволовой кроветворной клетки (см. Кроветворение), проходя в костном мозге последовательно стадии монобласта, промоноцита и моноцита. Последние циркулируют в крови, и, выселяясь в ткани, превращаются в М. Различают М. свободные (мигрирующие) и фиксированные в тканях. М. также подразделяют на гематогенные, образующиеся из только что выселившихся из крови моноцитов, и гистиогенные, которые ранее присутствовали в тканях. В зависимости от локализации различают М. рыхлой соединительной ткани — гистиоциты (см.), печени — звездчатые ретикулоэндотелиоциты (купферовы клетки), легкого — альвеолярные М., серозных полостей — перитонеальные и плевральные М., М. костного мозга и лимфоидных органов, глиальные макрофаги ц. н. с. (микроглии). Из М. происходят, по-видимому, и остеокласты.
М., являясь последней стадией дифференцировки одноядерных фагоцитов, не делятся митозом. Исключение, возможно, составляют М. в очагах хрон, воспаления. На основе общего происхождения из стволовой кроветворной клетки, строения и функции М. и их клетки-предшественники (моноциты и др.), согласно классификации, опубликованной в Бюллетене ВОЗ (1973), включены в систему мононуклеарных фагоцитов. В отличие от этого ретикулоэндотелиальная система (см.) объединяет клетки, имеющие различное происхождение и обладающие способностью к фагоцитозу: ретикулярные клетки, эндотелиальные клетки (в частности синусоидные капилляры кроветворных органов) и другие элементы.
Строение М. отличается разнообразием, зависящим от фагоцитарной активности, свойств поглощенного материала и пр. (рис. 1). В отличие от своих предшественников моноцитов (см. Лейкоциты) М. имеют большие размеры (20—100 мкм), содержат много плотных цитоплазматических гранул и митохондрий; в слабобазофильной (иногда оксифильной) цитоплазме нередко видны остатки фагоцитированного материала. Ядро сферической, бобовидной или неправильной формы. При наблюдении в фазовом контрастном микроскопе в М. выявляется характерная ундулирующая клеточная мембрана, совершающая волнообразные движения. При электронной микроскопии в М. виден хорошо развитый пластинчатый комплекс (см. Гольджи комплекс), обычно небольшое количество гранулярного эндоплазматического ретикулума. Отражением фагоцитарной активности являются плотные цитоплазматические гранулы — лизосомы (см.), фагосомы, мультивезикулярные остаточные тельца — так наз. миелиновые фигуры (рис. 2). Наблюдаются также микротрубочки и пучки микрофиламент.
Функц, значение М. определяется их высокой способностью к поглощению и переработке плотных частиц — фагоцитоз (см.) и растворимых веществ — Пиноцитоз (см.).
Значение макрофагов в иммунитете
М. являются своеобразным накопителем поступающих в организм антигенов (см.), которые находятся в нем в виде детерминант (участков молекулы антигена, определяющих его специфичность), состоящих не менее чем из 5 пептидов. Антигены подвергают особой переработке: взаимодействуя с рецепторами мембраны М. антигены вызывают активацию их лизосомальных ферментов и увеличение синтеза ДНК.
М. играют весьма существенную роль в индукции антителообразования, для к-рой необходимы все три типа клеток (макрофаги, Т- и В-лимфоциты). Антиген, связанный с различными фракциями М. (мембраны, лизосомы), является значительно более иммуногенным, чем нативный антиген. После обработки в М. антигены поступают к Т- и B-лимфоцитам (см. Иммунокомпетентные клетки). М., содержащие антиген, вначале реагируют с Т-клетками, и только после этого «включаются в работу» В-клетки. Взаимодействие М. с Т-клетками регулируется Н-антигенами или продуктом гена, связанного с системой генов гистосовместимости (см. Иммунитет трансплантационный).
Макрофаги, Т- и В-лимфоциты взаимодействуют друг с другом при помощи разнообразных растворимых факторов, выделяемых этими клетками после антигенной стимуляции. Высказано предположение, что большинство растворимых факторов выделяется Т-лимфоцитами. Хим. природа этих факторов не изучена. Передача иммунол, информации от М. к лимфоциту происходит при непосредственном контакте этих клеток. Механизм этой передачи заключается в «прилипании» М. к лимфоциту, что сопровождается выбуханием цитоплазмы М., к-рая затем сливается с выростом цитоплазмы лимфоцита. М. синтезируют большое количество неспецифических факторов иммунитета: трансферрин, комплемент, лизоцим, интерферон, пирогены и др., являющиеся антибактериальными факторами.
М. играют большую роль в антимикробном и антивирусном клеточном иммунитете, чему способствует и относительно большая продолжительность жизни этих клеток (примерно от одного до нескольких месяцев), а также в развитии иммунного ответа организма. Они осуществляют важнейшую функцию по освобождению организма от чужеродных антигенов. Переваривание микробов или немикробных агентов, патогенных грибков, простейших, продуктов собственных измененных клеток и тканей осуществляется при помощи лизосомальных ферментов М.
Как показывают многочисленные исследования, идея И. И. Мечникова о значении фагоцитарных клеток в иммунитете (см.) справедлива в отношении не только бактерий, но и вирусов. М., особенно иммунизированных животных, принимают активное участие в разрушении вирионов (см. Вирусы), несмотря на то что вирусы более устойчивы к действию ферментов и процесс их разрушения идет менее энергично, чем процесс разрушения бактерий. М. выполняют защитную функцию на различных этапах инф. процесса: они являются барьером на месте входных ворот инфекции и на стадии виремии, когда ограничению распространения вируса препятствуют М. печени, селезенки и лимф, узлов. С помощью М. ускоряется процесс выведения вируса из организма, точнее, комплекса антиген— антитело (см. Антиген—антитело реакция). М., полученные от неиммунизированных и иммунизированных животных, активно фагоцитируют вирусы гриппа, осповакцины, миксомы, эктромелии. Из иммунных М. вирус гриппа мог быть выделен лишь в течение нескольких часов, в то время как из неиммунных М. он изолировался в течение нескольких суток.
Блокирование в эксперименте М. антимакрофагальной сывороткой, кремнием, каррагинаном (высокомолекулярная полигалактоза) приводит к отягощению течения ряда бактериальных и вирусных инфекций. Однако при некоторых вирусных заболеваниях М. оказались не только неспособными предотвратить инфекцию, но, более того, поддерживали репродукцию вирусов (напр., вирусов лимфоцитарного хориоменингита), которые длительно сохранялись в организме, способствуя развитию аутоиммунных заболеваний.
Проведены исследования, показавшие участие М. в цитотоксическом действии сенсибилизированных лимфоцитов на клетки-мишени. В эксперименте показано, что удаление м. из популяции иммунных лимфоцитов вызывало значительное ослабление цитотоксического действия лейкоцитов на клетки некоторых опухолей и что прогноз заболевания тем благоприятнее, чем больше активных М. содержится в регионарных к опухоли лимф, узлах. Изучение реакций иммунной системы реципиента при трансплантации органов и тканей показало, что М. участвуют в отторжении трансплантата и в элиминации чужеродных клеток из организма (см. Трансплантация).
Библиография: Бернет Ф. М. Клеточная иммунология, пер. с англ., М., 1971; Ван Фюрт Р. и др. Система мононуклеарных фагоцитов, новая классификация макрофагов, моноцитов и их клеток-предшественников, Бюлл. ВОЗ, т. 46, № 6, с. 814, 1973, библиогр.; Здродовский П. Ф. Проблемы инфекции, иммунитета и аллергии, М., 1969, библиогр.; Косяков П. Н. и Ровнова 3. И. Противовирусный иммунитет, М., 1972; Петров Р. В. Иммунология и иммуногенетика, М., 1976, библиогр.; Учитель И. Я. Макрофаги в иммунитете, М., 1978; Аllisоn А. С. Interactions of antibodies complement components and various cell types in immunity against viruses and pyogenic bacteria, Transplant. Rev., v. 19, p. 3, 1974, bibliogr.; Carr I. The macrophage, L.— N.Y., 1973; Gordon S. a. Сohn Z. The macrophage, Int. Rev. Cytol., v. 36, p. 171, 1973, bibliogr.; Immunobiology of the macrophage, ed. by D. S. Nelson, N. Y., 1976; Mononuclear phagocytes in immunity, ed. by R. van Furth, Oxford, 1975; Wahl S. M. a. o. The role of macrophages in the production of lymphokines by T and B lymphocytes, J. Immunol., v. 114, p. 1296, 1975.
H. Г. Хрущов; М. С. Бердинских (иммунол.).
Макрофаги
Что такое клетки макрофаги и откуда они берутся?
Клетки макрофаги в самом деле большие: хотя их размер составляет всего 15-80 мкм, и человеческому глазу они не видны, однако они гораздо больше их предшественников: максимальный размер моноцита составляет всего 20 мкм. У них неправильная, «плавающая», меняющаяся форма, а их мембрана может образовывать ложноножки. Внутри макрофага находится ядро, а еще в нем обнаруживаются «осколки» эритроцитов и других клеток, жировые капельки, фрагменты бактерий и прочий «мусор». Как все это туда попадает? Очень просто, ведь макрофаги – это клетки, которые осуществляют процесс фагоцитоза.
Функции макрофагов:
При попадании в тело чужеродного объекта, будь то микроб или инородное тело, иммунная система сразу «спускает на него собак»: его атакуют фагоциты. Эти клетки, среди которых и макрофаги, распознают, улавливают и пожирают чужаков, угрожающих благополучию внутренней среды организма.
Кроме того, макрофаги уничтожают погибшие клетки, которые завершили свое существование процессом апоптоза (запрограммированная, естественная, нормальная гибель клеток). Также функции макрофагов заключаются в обеспечении противоопухолевого иммунитета: зафиксировав появление в организме атипичных, раковых клеток, макрофаги нападают на них и поедают.
Виды макрофагов:
Макрофаги – тканевые фагоциты, и в разных типах тканей нередко 
1. Альвеолярные макрофаги – находятся в стенках альвеол легких, очищают вдыхаемый воздух от различных загрязняющих и вредоносных частиц.
2. Купферовские клетки – в печени. Их назначение в основном заключается в уничтожении старых клеток крови.
4. Селезеночные макрофаги – располагаются в синусоидных сосудах этого органа. Как и у клеток Купфера, их задача заключается в том, чтобы вылавливать из крови и уничтожать отжившие клетки крови. Недаром селезенка называется кладбищем погибших эритроцитов!
5. Дендритные клетки – макрофаги, находящиеся под слизистыми оболочками и в коже, то есть фактически на границе с внешней средой.
6. Перитонеальные макрофаги – фагоциты, «живущие» в брюшине.
7. Где находятся макрофаги лимфатических узлов, понятно по названию. Это благодаря им лимфоузлы известны в качестве фильтров, очищающих лимфу.
Макрофаги и иммунная система:
Клетки макрофаги не просто бездумно уничтожают вредоносные объекты: расщепляя их на фрагменты, они осуществляют процесс презентации их антигенов. Антигены – это молекулы вредоносных частиц, которые говорят об их генетической чужеродности и вызывают соответствующую защитную реакцию со стороны иммунитета. Сами по себе они не представляют угрозы заражения или иного негативного воздействия, но это – метка чужака, поэтому организм реагирует на их присутствие защитной реакцией, как на полноценных агрессоров.
К сожалению, иногда личного опыта наших макрофагов или других фагоцитов недостаточно для того, чтобы иммунная система работала должным образом и правильно реагировала на вредоносные объекты. Чтобы повысить ее эффективность и заодно улучшить состояние здоровья в целом, рекомендуется принимать препарат Трансфер Фактор. Он содержит цитокины, несущие в себе данные о всевозможных возбудителях заболеваний, токсинах и прочих вредоносных агентах. Препарат обучает иммунитет полноценной работе, что немедленно и благоприятным образом отражается на течении имеющихся заболеваний, состоянии обмена веществ и функции органов. Средство можно использовать в лечебных и профилактических целях.
Макрофаги что к ним относится
ДЛЯ ТОГО ЧТОБЫ СКАЧАТЬ СТАТЬЮ В ФОРМАТЕ PDF ВАМ НЕОБХОДИМО АВТОРИЗОВАТЬСЯ, ЛИБО ЗАРЕГИСТРИРОВАТЬСЯ
В соответствии с «М1/М2» парадигмой выделяют два подтипа активированных макрофагов – классически активированные (М1) и альтернативно активированные (М2), которые экспрессируют различные рецепторы, цитокины, хемокины, факторы роста и эффекторные молекулы. Однако данные последних лет указывают на то, что в ответ на изменение сигналов микроокружения, макрофаги могут проявлять уникальные свойства, не позволяющие отнести их ни к одному из этих подтипов.
Макрофаги играют главную роль в реакции организма на имплантируемый материал – катетеры, стенты, эндопротезы, дентальные имплантаты. Макрофаги фагоцитируют частицы износа поверхности суставных протезов, инициируют воспаление в зоне протезирования и остеолиз, управляют процессами образования фиброзной капсулы вокруг инородных тел. Представлен краткий обзор факторов, вызывающих миграцию, адгезию и активацию макрофагов, анализ их функциональных характеристик на различных поверхностях, включая биодеградирующие и не деградирующие материалы in vivo и in vitro.
Введение
Современную медицину в настоящее время невозможно представить без применения имплантируемых изделий, устанавливаемых в организм на различные сроки с целью восстановления анатомии и функции утраченных или пораженных патологическим процессом органов и тканей. Биосовместимость синтетических материалов или тканеинженерных конструкций является основной проблемой, влияющей на результаты таких имплантаций. Реакция на протезирующий материал развивается в следующей последовательности: альтерация тканей, инфильтрация клетками острого, затем хронического воспаления с формированием грануляционной ткани и фиброзной капсулы. Степень выраженности этих реакций определяет биосовместимость имплантируемого изделия. Макрофаги играют главную роль в реакции организма на устанавливаемый материал – катетеры, стенты, эндопротезы, дентальные имплантаты и др.
Морфология макрофагов
Функции макрофагов
Миграция моноцитов/макрофагов
Тканевые макрофаги происходят преимущественно из моноцитов крови, которые мигрируют в ткани и дифференцируются в различные популяции. Миграция макрофагов направляется хемокинами: ССL2 CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, ССL15, ССL19, CXCL10, CXCL12; факторами роста VEGF, PDGF, TGF-b; фрагментами системы комплемента; гистамином; белками гранул полиморфноядерных лейкоцитов (ПМЯЛ); фосфолипидами и их производными.
Активация макрофагов
Эти исследования наглядно показывают, что формирующиеся в естественных условиях популяции макрофагов значительно отличаются от получаемых in vitro М1 и М2 популяций. Воспринимая множество активирующих сигналов, макрофаг отвечает «по запросу», секретируя медиаторы адекватно изменению окружающей среды, поэтому в каждом конкретном случае формируется свой фенотип, иногда, возможно, даже уникальный.
Реакция макрофагов на чужеродный материал
Адсорбция белков плазмы крови является первой стадией взаимодействия имплантируемых материалов с тканями организма. Химический состав, свободная энергия, полярность поверхностных функциональных групп, степень гидрофильности поверхности определяют количество, состав и конформационные изменения в связываемых белках, являющихся матриксом для последующей адгезии клеток, в том числе макрофагов. Наиболее значимыми в этом плане являются фибриноген, IgG, белки системы комплемента, витронектин, фибронектин и альбумин.
В этой связи существенное значение приобретают изучение клеточных популяций в зоне протезирования, разработка методов и подходов к блокированию чрезмерной воспалительной реакции с исходом в фиброз и стимуляция репаративной регенерации в месте имплантации различных материалов.
Заключение
Макрофаги – полиморфная популяция клеток, фенотип которых определяется сигналами микроокружения. Они играют решающую роль в реакции организма на чужеродный материал, используемый для эндопротезирования, катетеризации, стентирования и др. видов лечения. Характер реакции и степень ее выраженности зависят как от размера имплантируемого материала, так и от его физикохимических свойств и могут иметь как положительное, так и отрицательное значения для организма пациента. Для деградируемых материалов на основе коллагена показана зависимость типа активации макрофагов и скорости регенерации соединительной ткани от способа обработки коллагенового сырья. Это открывает широкие возможности для специалистов, разрабатывающих новые методы децеллюляризации тканей, химической модификации и стерилизации коллагеновых материалов в целях получения имплантатов для регенеративной медицины.
Проблемы, связанные с активацией макрофагов недеградирующими материалами, по-видимому, должны решаться иначе. Макрофаги, фагоцитирующие микрочастицы износа поверхности суставных эндопротезов, и макрофаги, мигрирующие к обширным поверхностям синтетических имплантов, инициируют длительно персистирующее воспаление, остеолиз в первом случае и фиброз во втором. Нивелирование этого эффекта, скорее всего, будет достигнуто путем блокады направленной миграции, адгезии и активации моноцитов/макрофагов, что потребует более глубоких знаний об этих процессах, чем те, которыми мы располагаем в настоящее время.
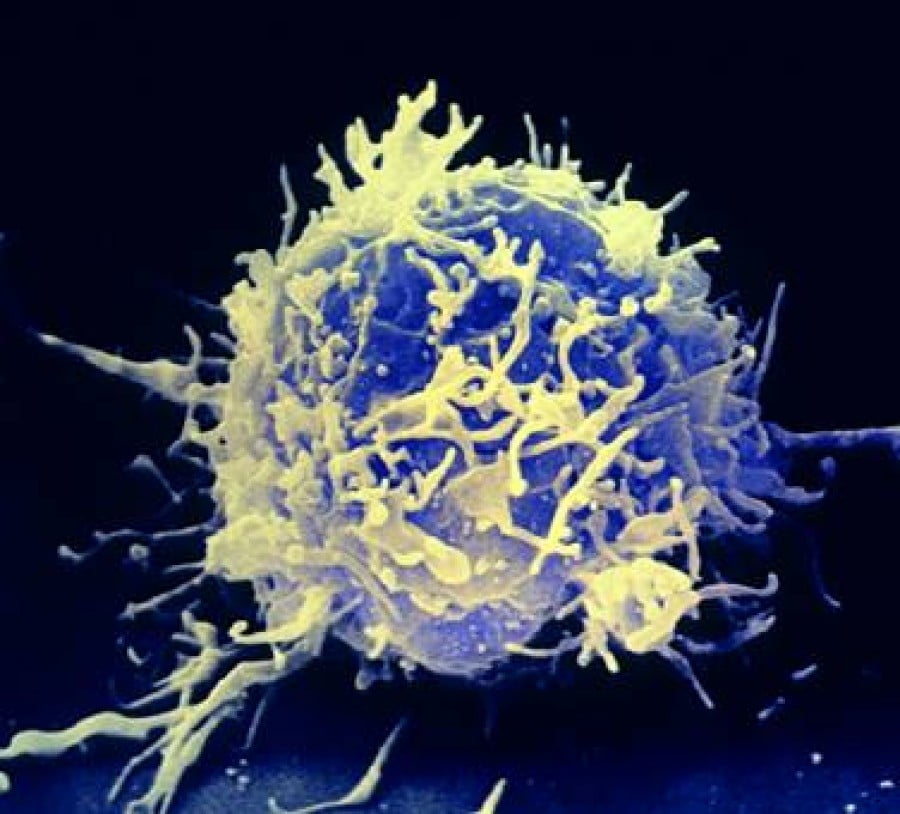
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
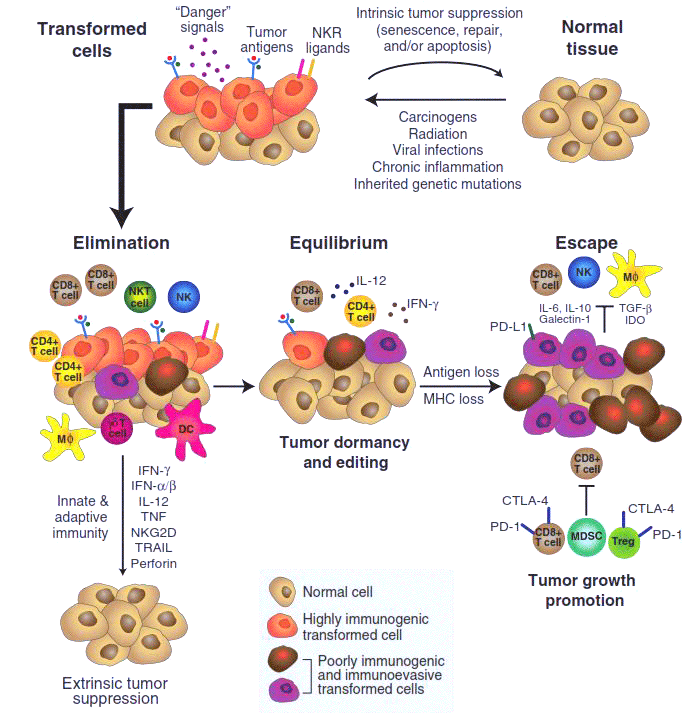
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
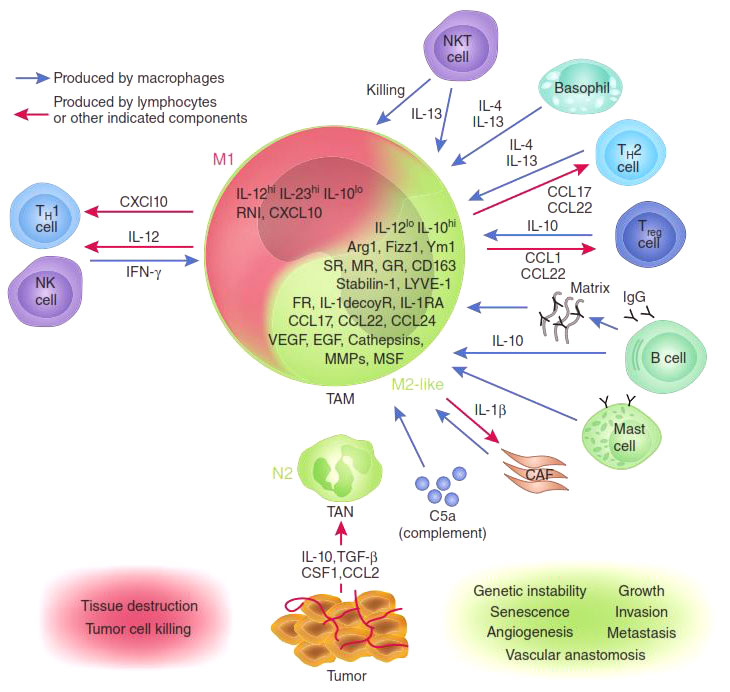
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.