Как посчитать концентрацию раствора при разбавлении
Формулы для пересчета концентраций растворов
В приводимой ниже таблице приняты следующие обозначения:
М — мольная масса растворенного вещества, г/моль; Э — эквивалентная масса растворенного вещества, г/моль; р — плотность раствора, г/мл.
* Дли жидкостей может применяться величина Pv, % (об.) —число миллилитров растворенной жидкости в 100 мл раствора.
РАСЧЕТНЫЕ ФОРМУЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРОВ
Для приготовления определенного количества раствора какого-либо вещества заданной концентрации исходят из следующих данных: а) из количества чистого вещества и растворителя; б) из количества раствора данного вещества с более высокой концентрацией, чем заданная, и количества чистого растворителя или в) из количества двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше.
Растворение вещества в воде
Пусть требуется приготовить А граммов раствора концентрации P [в % (масс.) ]. Тогда:
(I) 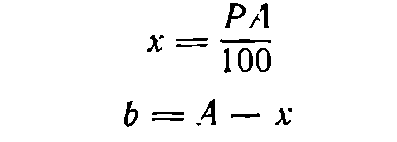
(2)
где х— необходимая масса растворяемого вещества, г; b—необходимая масса воды, г.
Если нужно приготовить определенный объем V раствора (в мл) концентрации Р, находят по таблицам плотность р (в г/см3) раствора данного вещества требуемой концентрации. Поскольку А = Vp, формула (1) будет иметь вид:
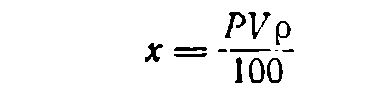
(3)
В тех случаях, когда растворяемое вещество представляет собой кристаллогидрат, т. е. содержит кристаллизационную воду, для расчета необходимого его количества используют формулу:
(4) 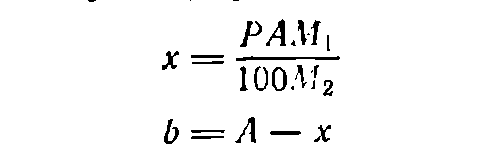
(5)
где х— необходимая масса кристаллогидрата, г; M1—мольная масса кристаллогидрата; М2—моль-мая масса вещества без кристаллизационной воды; b — необходимая масса воды, г.
Если нужно приготовить раствор объемом V (в мл) заданной нормальности N, вычисляют значение эквивалентной массы Э растворяемого вещества, после чего находят необходимую его навеску (в г) по формуле:
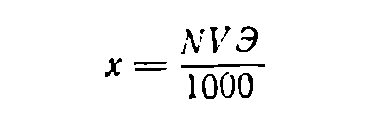
(6)
При приготовлении раствора заданной молярной концентрации применяют аналогичную формулу:
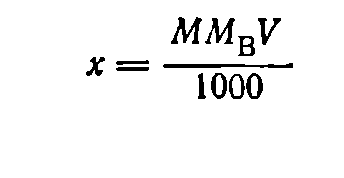
(7)
где М — молярная концентрация раствора; Мв — мольная масса растворяемого вещества; V — заданный объем раствора, мл.
Разбавление раствора водой
Пусть требуется приготовить раствор концентрации Р2 из имеющегося раствора с более высокой концентрацией Р1. Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2.
(9) 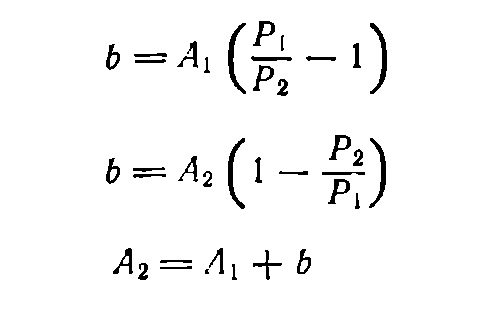
(10)
В тех случаях, когда известна не масса, а объем раствора, необходимо по таблицам найти плотности растворов данного вещества исходной и конечной концентраций — p1 и р2 соответственно. Тогда, если нужно приготовить раствор объемом V2 (в мл) концентрации Р2 [в % (масс.)], а концентрация исходного раствора равна P1 [(в % (масс.)], то объем исходного раствора вычисляется по формуле:
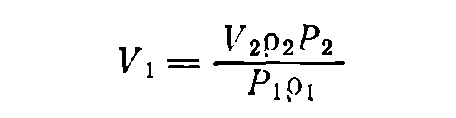
(11)
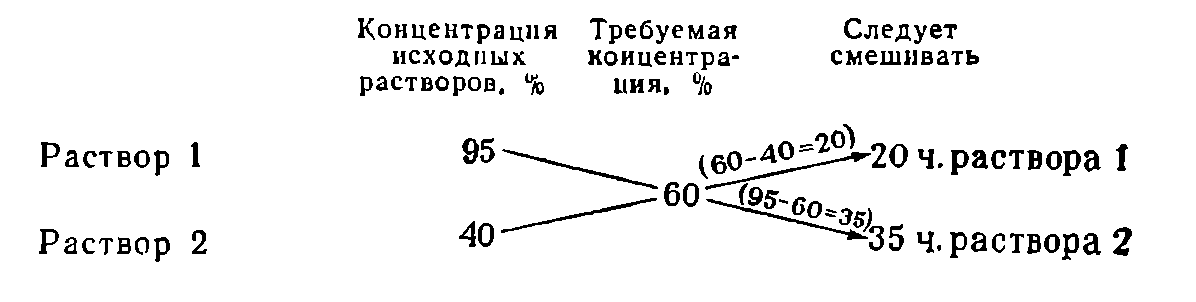
Смешивание двух растворов различной концентрации
Пусть требуется приготовить раствор заданной концентрации из двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше. Чтобы определить, в каких пропорциях следует смешивать растворы, пользуются «правилом креста», которое наглядно показано на следующем примере:
Смешиваемые растворы можно измерять в объемных или массовых частях в зависимости от того, в объемных или массовых процентах выражают концентрацию растворов.
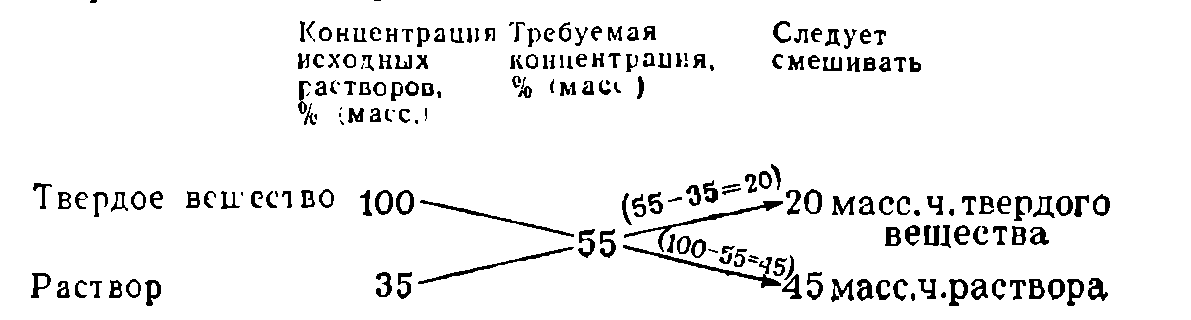
«Правило креста» можно применять и в случаях разбавления раствора чистым растворителем. При этом концентрацию вещества в чистом растворителе считают равной нулю:
Для получения более концентрированного раствора растворением в нем дополнительного количества компонента твердое вещество условно считают раствором с концентрацией 100%:
Концентрация растворов. Способы выражения концентрации растворов.
Концентрация раствора может выражаться как в безразмерных единицах (долях, процентах), так и в размерных величинах (массовых долях, молярности, титрах, мольных долях).
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:

ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:

C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:

С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
4. Титр – содержание вещества в граммах в 1 мл раствора:

T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:

N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
Иногда при решении задач необходимо переходить от одних единиц выражения к другим:
М(Х) – молярная масса растворенного вещества;
ρ= m/(1000V) – плотность раствора. 6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
Калькулятор разбавления концентрированного химического вещества
Разбавление раствора — это уменьшение концентрации вещества путем добавления растворителя или менее концентрированного раствора, при этом количество вещества остается неизменным. Разбавление растворов происходит постоянно, как в научных биохимических экспериментах, так и на кухне при приготовлении напитков.
Количество вещества и молярная масса
Для начала следует разобраться с такими понятиями, как моль и количества вещества. Итак, моль — это такое количество химического вещества, в котором содержится 6,022 × 10 23 частиц, атомов или молекул. Значение 6,022 × 10 23 — это число Авогадро, выбранное как количество атомов, которые содержатся в 12 граммах углерода-12. Следовательно, моль любого вещества — это 6,022 × 10 23 его структурных единиц. Например, если говорится об одном моле простого атомарного гелия He, то имеется в виду 6,022 × 10 23 атомов. Если же речь идет об одном моле соляной кислоты HCl, то подразумевается 6,022 × 10 23 молекул.
Молярная масса — масса в граммах одного моля вещества. Этот параметр легко определить при помощи периодической таблицы, суммировав атомные веса элементов, составляющих молекулу. Например, один моль воды H20 весит 18 грамм, так как атомный вес кислорода составляет 16 единиц, а водорода — 1 единицу. Следовательно, по формуле H2O молярная масса выражается как 16 + 1 × 2 = 18.
Раствор и концентрация
Раствор — это однородная смесь растворенного вещества и растворителя. Раствор можно приготовить при помощи смешения жидкости и твердого вещества или жидкости и газа. В этих случаях жидкость выступает в роли растворителя, а газ или твердое тело — растворенного вещества. Если смешиваются две жидкости, то растворителем считается менее концентрированная жидкость. При этом разбавление растворов — это как раз о концентрации, но как она выражается?
Молярность или молярная концентрация — это количество вещества в молях в 1 литре раствора. Например, раствор соляной кислоты с молярностью в 2 моля записывается как 2M HCl. Это означает, что в одном литре раствора соляной кислоты содержится 2 моля вещества, а так как молярная масса хлороводорода составляет 36,46 грамм на моль, то в литре раствора содержится 36,46 × 2 = 72,92 грамма соляной кислоты.
Концентрация растворов может измеряться и по-другому. Моляльность — это количество вещества в молях в 1 килограмме растворителя. Обратите внимание на разность между молярностью и моляльностью: в первом случае измеряется количество вещества по отношению к литру раствора, во втором — к килограмму растворителя. Например, если растворить 36,46 г соляной кислоты в 1 литре этанола, то его молярность будет равна 1 моль/л. Моляльность же выражается по отношению к килограмму растворителя, в роли которого в примере выступает этанол. Масса 1 литра этанола составляет 789 грамм (0,789 кг), поэтому моляльность раствора будет равна 1 моль / 0,789 кг = 1,26 моль/кг.
Понятно, что если взять литр этанола и залить им соляную кислоту, то раствор получит меньшую молярность, так как в сумме объем раствора будет несколько больше, чем один литр. Во избежание таких ошибок требуется добавить в колбу требуемую массу вещества, и только после этого долить растворитель до заданной отметки.
Разбавление раствора
Самый банальный пример разбавления раствора — это смешение алкогольных напитков с водой, соком или содовой. Из примера видно, что разбавление растворов требуется для уменьшения их концентрации, и если при смешивании коктейлей снижается крепость «раствора», то в химии снижается молярность. Важно помнить, что количество молей растворенного вещества при этом не изменяется. Параметры раствора при разбавлении подчиняются следующему закону:
где c1 и v1 — молярная концентрация и объем раствора до разбавления, а c2 и v2 — после разбавления.
Это элементарная пропорция, при помощи которой легко регулировать желаемую концентрацию или объем разбавленного раствора. Рассмотрим подробнее.
Определение концентрации
Посчитаем молярную концентрацию раствора, полученного путем разбавления 200 мл 5М раствора до 5 литров. Для правильного расчета выразим объемы растворов в одних единицах измерения и запишем пропорцию:
Теперь достаточно выразить концентрацию c2 = (5 × 200) / 5000 = 0,2 М. Таким образом, разбавление раствора до 5 литров снизило его молярность до 0,2 молей.
Определение объема
Теперь определим, какой объем раствора необходим, чтобы концентрация 200 мл 5М снизилась до 2М. Вновь запишем пропорцию:
Выразим объем и получим v2 = 5 × 200 / 2 = 500 мл. Следовательно, для уменьшения концентрации раствора до 2 моль требуется увеличить объем раствора до 500 мл.
Наша программа представляет собой калькулятор, который вычисляет финальную концентрацию разбавленного вещества. В элементарной пропорции наибольшую трудность вызывает приведение единиц к одной размерности. Например, что делать, если требуется разбавить раствор молярностью 30 наномоль для получения раствора с концентрацией 5 фемтомоль? Для решения подобных задач и разработан наш калькулятор. Для решения задачи требуется ввести значения в соответствующие ячейки и выбрать единицы измерения.
Заключение
Разбавление растворов — практическая задача, которая встречается не только в химической лаборатории, но и на кухне. Для простых бытовых расчетов легко использовать пропорцию, но для более точных вычислений используйте наш онлайн-калькулятор.
Расчеты концентрации
растворенных веществ
в растворах
Решение задач на разбавление растворов особой сложности не представляет, однако требует внимательности и некоторого напряжения. Тем не менее можно упростить решение этих задач, используя закон разбавления, которым пользуются в аналитической химии при титровании растворов.
Во всех задачниках по химии показаны решения задач, представленных как образец решения, и во всех решениях используется закон разбавления, принцип которого состоит в том, что количество растворенного вещества 
Рассмотрим проблему решения задач на разбавление, исходя из следующих соображений.
• Количество растворенного вещества 
где c – молярная концентрация растворенного вещества в моль/л, V – объем раствора в л.
• Масса растворенного вещества m(р.в.):
m(р. в.) = m(р-ра)•
где m(р-ра) – масса раствора в г, 
Обозначим в исходном (или неразбавленном) растворе величины c, V, m(р-ра), 
m1(р-ра), 

Составим уравнения разбавления растворов. Левые части уравнений отведем для исходных (неразбавленных) растворов, а правые части – для разбавленных растворов.
Неизменность количества растворенного вещества при разбавлении будет иметь вид:
Сохранение массы m(р. в.):
Количество растворенного вещества 

где M(р. в.) – молярная масса растворенного вещества в г/моль.
Уравнения разбавления (1) и (2) связаны между собой следующим образом:
с1•V1 = m2(р-ра)•
m1(р-ра)•
Если в задаче известен объем растворенного газа V(газа), то его количество вещества 

Уравнения разбавления примут соответственно вид:
V(газа)/22,4 = m2(р-ра)•
Если в задаче известны масса вещества или количество вещества, взятого для приготовления раствора, то в левой части уравнения разбавления ставится m(р. в.) или 
Если по условию задачи требуется объединить растворы разной концентрации одного и того же вещества, то в левой части уравнения массы растворенных веществ суммируются.
Довольно часто в задачах используется плотность раствора 
Приведем примеры решения «образцовых» задач.

Дано:
Найти:
Решение
Ответ. V1 = 50 мл.



Дано:

m2(р-ра) = 500 г, 
Найти:
Решение
m1(р-ра)•

Найдем массу добавляемой воды:
m(H2O) = 500 – 100 = 400 г.

(
Дано:


с2 = 0,35 моль/л,
V2 = 0,04 л,
М(H2SO4) = 98 г/моль.
Найти:
Решение
m1(р-ра)•
V1•

Подставляем значения известных величин:
Отсюда V1 = 0,01405 л, или 14,05 мл.
Ответ. V1 = 14,05 мл.


(или 10%)?
Дано:
V(р-ра) = 1 л,


М(HCl) = 36,5 г/моль.
Найти:
Решение
V(HCl)/22,4 = m(р-ра)•
V(HCl)/22,4 = V(р-ра)•

Отсюда V(HCl) = 64,44 л.
Найдем массу добавляемой воды:
m(H2O) = V(р-ра)•
m(H2O) = 1•1050 – 64,44/22,4•36,5 = 945 г.
Ответ. 64,44 л HCl и 945 г воды.

Дано:


М(NaOH) = 40 г/моль.
Найти:
Решение
m(р-ра)• 
m(р-ра)• 

Разделим обе части уравнения на m(р-ра) и подставим численные значения величин.
Отсюда c = 6,1 моль/л.
Ответ. c = 6,1 моль/л.

Дано:
m(Na2SO4) = 42,6 г,
m(H2O) = 300 г,

M(Na2SO4) = 142 г/моль.
Найти:
Решение
Подставляя численные значения, получим:
42,6 = с•(42,6 + 300)/1120•142.
Отсюда с = 0,98 моль/л.
Ответ. с = 0,98 моль/л.

Дано:



m3(р-ра) = 300 г.
Найти:
Решение
m1(р-ра)•


Поскольку m1(р-ра) + m2(р-ра) = 300 г, то получаем систему из двух уравнений с двумя неизвестными. Решая совместно два уравнения, находим:

Дано:
m1(NaF) = 4,1 г,
m2(NaF) = 4,5 г,
m2(р-ра) = 500 г,

(1 – 
Найти:
Решение
m2(р-ра)•(1 – 

Отсюда m1(р-ра) = 104,1/104,5•500 = 498,09 г,
m(NaF) = 500 – 498,09 = 1,91 г.
Ответ. m(NaF) = 1,91 г.
ЛИТЕРАТУРА
1. Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в вузы. М.: Новая волна, 2002.
2. Фельдман Ф.Г., Рудзитис Г.Е. Химия-9. М.: Просвещение, 1990, с. 166.