метрономная химиотерапия что это такое
Метрономная терапия: место в лечении злокачественных опухолей
Авторы: В.А. Чубенко, Л.А. Загорская, В.С. Чубенко, Ф.В. Моисеенко, Н.Х. Абдулоева, А.С. Жабина, М.М. Крамчанинов, К.В. Шелехова, А.А. Мелдо, Е.М. Зыков, А.А. Кудрявцев, Е.В. Напольская, В.М. Моисеенко
Одной из стратегий преодоления возможной резистентности на фоне современного лекарственного лечения является метрономная терапия злокачественных опухолей. Это хроническое непрерывное введение низких доз лекарственных препаратов с целью воздействия как на опухолевые клетки, так и на их микроокружение для того, чтобы изменить естественную историю роста злокачественных опухолей и увеличить продолжительность жизни больных.
Целью работы было изучить эффективность метрономного режима циклофосфамида и метотрексата у больных различными злокачественными опухолями.
Материалы и методы. Проанализирован опыт применения схемы метрономной терапии циклофосфамид и метотрексат за 3,5 года в Онкоцентре. Из 678 больных подавляющее большинство (377) составили пациенты старшей возрастной группы. При этом 343 больных находились в ослабленном и тяжелом состоянии (ECOG 2-4). МТ назначалась в различных линиях лечения, но в основном, при развитии резистентности к стандартной терапии (со 2-й и более). С точки зрения нозологии, больные были крайне гетерогенны (рак толстой кишки – 103, рак молочной железы – 84, опухоли головы и шеи – 80, рак легкого –78 и первично-множественные опухоли – 72). Степень распространения процесса занимала, как правило, 2 и более органов. Чаще встречались аденокарциномы и плоскоклеточный рак.
Результаты. Объективный ответ опухоли на лечение составил 8,1%. При этом стабилизация процесса – 68,9%. Прогрессирование было зарегистрировано в 23% случаях. Медиана времени до прогрессирования составила 7 месяцев. Схема метрономной терапии переносилась удовлетворительно и не имела выраженной клинически значимой токсичности.
Выводы. Работа демонстрирует клиническую эффективность применения метрономного режима циклофос-
фамид и метотрексат при различных злокачественных новообразованиях.
Внимание
Этот раздел сайта содержит профессиональную специализированную информацию.
Вы являетесь дипломированным медицинским специалистом?
Метрономная химиотерапия
27.05.2019 | Статьи и новости | 2019-05-27 13 августа 2019
Метрономная химиотерапия, химиотерапия с низкими дозами: алопеция уменьшается до 1% — это надежда будущего.
Преимущества метрономной химиотерапии при лечении рака в Италии
Низкая токсичность, хороший иммунный ответ и мало побочных эффектов. Это преимущества метрономной химиотерапии, которая, как было показано, очень эффективна, особенно при распространенных формах рака.
При метрономной химиотерапии уменьшаются побочные эффекты, резко уменьшается даже выпадение волос, но при этом сохраняется или даже увеличивается эффективность лечения. Именно это и продемонстрировала метрономная химиотерапия — новый подход к лечению опухолей в клиниках Италии. Этот метод заключается в непрерывном введении лекарственных препаратов в низких дозах, а не в высоких дозах (максимально переносимых) для коротких циклов при интервалах 2 или 3 недели, как это делается при стандартной химиотерапии.
Стратегия, успешно апробированная в Италии при метастатическом раке молочной железы, одобренная европейскими директивами по этому новообразованию и которая с сегодняшнего дня будет приобретать все большее распространение благодаря новой Международной школе по метрономической химиотерапии.
Разные дозы, разные эффекты
Исследования показывают, что разные дозы и время введения одного и того же лекарственного средства вызывают разные воздействия на опухолевую клетку, но прежде всего на то, что ее окружает, то есть так называемую опухолевую микросреду. Поэтому, модулируя дозу и скорость введения, можно в конечном итоге оказывать различное действие: на сосуды опухоли, на стимуляцию иммунного ответа или на раковые стволовые клетки.
В отличие от обычной химиотерапии, которая оказывает сильное прямое воздействие на опухолевые клетки, основной целью метрономной терапии является, по сути, неоваскуляризация(т.е. образование новых кровеносных сосудов), которые питают опухоль. И одним из ее преимуществ является низкая токсичность для костного мозга. Ясно, что ключевой ролью в этом подходе является выбор правильной дозы препарата, что требует идентификации одного биомаркера.
Как функционирует метрономическая химиотерапия
Метрономика не только оказывает прямую токсичность на опухолевые клетки, но и влияет на их микроокружение, поскольку она ингибирует неопластический ангиогенез, другими словами, механизм образования новых кровеносных сосудов, отвечающих за рост опухоли и метастазирование.
Ее эффективность продемонстрирована при некоторых формах рака молочной железы, рака легких, лимфом, злокачественных новообразований у детей и во многих случаев опухолей на поздних стадиях. Она не только эффективна и имеет профиль низкой токсичности, она также способна модулировать иммунный ответ, уменьшая побочные эффекты — у менее чем 1% пациентов наблюдается алопеция и неврологическая токсичность менее чем у 5%. Не говоря уже об огромной экономии, которую предлагает оральная терапия в домашних условиях.
«Некоторым это может показаться второстепенным, но с помощью этой терапии я не потеряла свои волосы, как это могло бы случиться с традиционным химиотерапией», — говорит Антонелла Парма, пациентка, которая проходит курс лечения в течение 9 месяцев: «Кроме того, меня не заставляют часто проводить обследования крови. Я делаю свои проверки, когда я иду в больницу, чтобы забрать таблетки для терапии. В принципе, я могу продолжать жить обычной жизнью».
Метрономная химиотерапия что это такое
Клинический научно-практический центр специализированных видов медицинской помощи (онкологический), Санкт-Петербург, Россия
Введение
На сегодняшний день перспективным методом лекарственного лечения злокачественных новообразований являются стратегии, основанные на поиске и подавлении «триггерных» мишеней с учетом биологии роста опухоли [1]. К ним относятся следующие ингибиторы:
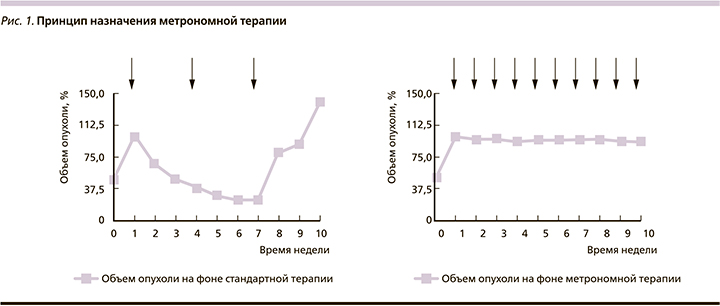
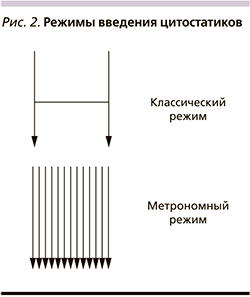
В итоге в арсенале клинического онколога принципиально имеются следующие возможности воздействия на злокачественные клетки: цитостатики, таргетная терапия, иммунотерапия и экспериментальные направления, целью которых служат регуляция метаболизма опухоли и эпигенетическая терапия. В результате подобные методы, безусловно, приводят к увеличению продолжительности жизни. Например, лекарственная терапия современными препаратами увеличивает медиану общей выживаемости больных раком молочной железы (РМЖ) с 32 до 50 месяцев [2],толстой кишки с 5–6 до 30 [3], желудка с 3–5 до 16 [4], легкого с 3,9 до 36 месяцев [5]. С другой стороны, иммунотерапевтические принципы лечения позволяют обсуждать 20%-ную возможность излечения. К сожалению, подобные успехи в большинстве своем характерны для определенной группы больных с учетом специфических предиктивных факторов [6]. В общей популяции подобная тенденция не столь выражена. Это обусловлено многими факторами, к которым относятся особенности кинетики роста, гетерогенность опухолевой популяции, опухолевая эволюция, репопуляция клеток, лекарственная резистентность, микроокружение или опухолевый матрикс, эпигенетические нарушения, тканевая иммуносупрессия, константы гомеостаза (pH, гликемия), стволовые клетки [7]. С целью возможности преодоления подобной резистентности опухолевых клеток разрабатываются новые стратегии терапии. К ним относится метрономная терапия (МТ) злокачественных опухолей. Это один из вариантов dose-dense терапии, в котором химиопрепараты назначаются через определенные короткие промежутки времени (часы, дни, недели) в низких (10–40% от терапевтической) дозах с целью увеличения продолжительности жизни больных неизлечимыми диссеминированными солидными опухолями [8]. Концепция применения метрономной терапии заключается в торможении роста злокачественных клеток, что теоретически снизит вероятность достижения «летального» объема опухоли и тем самым может повлиять на показатели выживаемости (рис. 1).
Метрономная терапия: от истоков к современности
История МТ началась с работ J. Folkman, который предположил возможность терапевтического воздействия на опухолевый ангиогенез [9]. В 1991 г. в лаборатории R. Kerbel было показано влияние цитостатиков на сосудистое русло в опухоли. В дальнейшем исследования Klement и Browder продемонстрировали возможность достижения значительного торможения роста опухоли низкими дозами химиопрепаратов на различных преклинических моделях. В то же время Hanahan предложил термин «метрономная терапия» [10].
Механизм действия МТ заключается в снижении пролиферации и ангиогенного потенциала эндотелиоцитов в опухоли, повышении экспрессии тромбоспондина-1, подавлении функции циркулирующих эндотелиальных клеток, блокаде мобилизации клеток-предшественниц эндотелиоцитов из костного мозга, а также в нормализации структуры сосудистой сети и в повышении перфузии опухолевой ткани.
Кроме того, обсуждается значительное влияние низких доз цитостатиков на регуляцию иммунной системы организма в виде повышения иммуногенности и возможности презентации антигенов, на мобилизацию антиген-презентирующих клеток, подавление функции Т-регуляторов и на повышение активности цитотоксических лимфоцитов. Несомнен факт их прямого воздействия на опухолевые клетки [11].
В качестве примера изучено антиангиогенное действие препаратов, связывающих микротрубочки. Оно заключается в повышении динамической нестабильности микротрубочек, нарушении переориентации центра организации микротрубочек, ослаблении сигнала от рецептора сосудистого эндотелиального фактора роста 2-го типа, пониженнии активации интегрина, ингибировании сигнала FAK/паксиллин/AKT, потере Hsp90, ингибировании активации eNOS, нарушении образования фокальных контактов, пониженной пролиферации и поляризации клеток, подавлении миграции клеток, разрушении связи микротрубочка+белок TIP, реорганизации актина в стресс-волокна, ингибировании сигнала Ras/Erk/Net (Elk3), повышении фосфорилирования MLC и сократимости актиномизина, изменении сигнала Rho-GTP-аза, разрушении VE-кадгерина, ингибировании сигнала VE-кадгерин/β-катенин/AKT, ингибировании образования трубочек, повышении проницаемости клеток, в регрессии капиллярных трубочек [12].
Эффективность МТ продемонстрирована во многих клинических исследованиях. Объективный ответ опухоли на лечение в среднем составлял 19–34% [15]. Мета-анализ 22 исследований метрономного режима при РМЖ, в который были включены 1360 больных, показал клиническую эффективность в 55% случаев, время до прогрессирования 6 месяцев — 56% больных и 2-летнюю общую выживаемость — 40% [15]. Среди особенностей подобных работ можно выделить следующие: в основном исследования I—II фаз, гетерогенность включенных пациентов, эмпирический выбор цитостатиков и режима, использование в качестве оценки эффективности лечения объективного ответа, а не общей выживаемости. В целом для МТ при РМЖ предпочтение отдавалось препаратам с высокой биодоступностью при применении внутрь и возможности частого внутривенного введения цитостатиков. В качестве примера назначение пожилым больным винорелбина внутрь в метрономном режиме приводило к увеличению времени до прогресирования болезни до 9,2 месяца [16].
Эффективность комбинации метрономного режима применения цитостатиков была продемонстрирована в исследовании VICTOR-2. В нем приняли участие 80 больных, из которых у 28 был диагностирован тройной негативный фенотип РМЖ. Капецитабин и винорелбин назначались в 1-й (35 больных) и 2-й линиях (45 больных) лечения. Частота объективного ответа составила 35,5 и 25,6% соответственно. Время до прогрессирования, превысившее 1 год, регистрировалось более чем у 20% больных. При этом клинически значимой токсичности практически не наблюдалось: фебрильная нейтропения была зарегистрирована у 0,4%, а слабость у 0,7% больных [17]. Низкая токсичность при применении метрономного режима применения цитостатиков послужила основанием исследования тройной комбинации препаратов в низких дозах при РМЖ. В исследовании VEX время до прогрессирования на фоне метрономного применения циклофосфамида, капецитабина и винорелбина в первой линии лечения составило 25,1 месяца [18]. Несмотря на активное изучение новых метрономных доз винорелбина, в клинические рекомендации лечения РМЖ в Российской Федерации входят следующие эффективные режимы его применения: 60 мг/м2 внутрь в 1-й, 8-й и 15-й дни; с 22-го дня — 80 мг/м2 1 раз в неделю.
По сравнению со стандартным режимом введения метрономный винорелбин демонстрирует схожую эффективность при более низкой токсичности. В исследовании XeNa объективный ответ опухоли составил 21,4 и 20,8%, клиническая эффективность — 37 и 41%, общая выживаемость — 660 и 701 день соответственно [19].
Заключение
Таким образом, МТ представляет собой новую парадигму лекарственного лечения в связи с интегрирующим воздействием как на опухолевые клетки, так и на их микроокружение. Данный подход демонстрирует клиническую эффективность определенной группы больных, резистентных к стандартной терапии. При этом длительная стабилизация процесса (более 6 месяцев), вероятно, может быть суррогатным маркером увеличения продолжительности жизни. С учетом механизма действия низких доз цитостатиков перспективным считается комбинация препаратов с различными терапевтическими опциями (иммунотерапия, антиангиогенная терапия).
На сегодняшний день подобная стратегия терапии требует изучения предиктивных маркеров. А с целью получения доказательной базы, безусловно, необходимо проведение масштабных рандомизированных исследований.
Литература
1. Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation. Cell. 2011;144(5):646–74. Doi: 10.1016/j.cell.2011.02.013.
2. Engel, J., Schubert-Fritschle G., Emeny R., Hölzel D.Breast cancer: are long-term and intermittent endocrine therapies equally effective? J Cancer Res Clin Oncol. 2020 May 29. Doi: 10.1007/s00432-020-03264-0.
3. Aggarwal H., Sheffield K.M., Li L., et al. Primary tumor location and survival in colorectal cancer: A retrospective cohort study. World J Gastrointest Oncol. 2020;12(4):405–23. Doi: 10.4251/wjgo.v12.i4.405.
4. Yarema R., Оhorchak М., Hyrya P., et al. Gastric cancer with peritoneal metastases: Efficiency of standard treatment methods. World J Gastrointest Oncol. 2020;12(5):569–81. Doi: 10.4251/wjgo.v12.i5.569.
5. Xu E., David E.A., Ding L., et al. Sequence of biologic therapies and surgery affects survival in non-small cell lung cancer. J Surg Oncol. 2020. May 20. Doi: 10.1002/jso.25937.
6. Cristescu R., Mogg R., Ayers M., et al. Pan-tumor genomic biomarkers for PD-1 checkpoint blockade-based immunotherapy. Science. 2018;362(6411):eaar3593. Doi: 10.1126/science.aar3593.
7. Murciano-Goroff Y.R., Warner A.B., Wolchok J.D.The future of cancer immunotherapy: microenvironment-targeting combinations. Cell Res. 2020. Doi: 10.1038/s41422-020-0337-2.
8. Hanahan D., Bergers G., Bergsland E. Less is more, regularly: metronomic dosing of cytotoxic drugs can target tumor angiogenesis in mice. J Clin Invest. 2000;105(8):1045–47. Doi: 10.1172/JCI9872.
9. Abdollahi A., Hlatky L., Huber P.E. Endostatin: the logic of antiangiogenic therapy. Drug Resist Updat. 2005;8(1–2):59–74. Doi: 10.1016/j.drup.2005.03.001.
10. Bocci G., Kerbel R.S. Pharmacokinetics of metronomic chemotherapy: a neglected but crucial aspect. Nat Rev Clin Oncol. 2016;13(11):659–73. Doi: 10.1038/nrclinonc.2016.64.
11. André N., et al. Metronomics: towards personalized chemotherapy? Nat Rev Clin Oncol. 2014. Doi: 10.1038/nrclinonc.2014.89.
12. Schwartz E.L. Antivascular actions of microtubule-binding drugs. Clin Cancer Res 2009;15(8):2594–601. Doi: 10.1158/1078-0432.CCR-08-2710.
13. Shaked Y., Pham E., Hariharan S. Evidence Implicating Immunological Host Effects in the Efficacy of Metronomic Low-Dose Chemotherapy. Cancer Res. 2016;76(20):5983–993. Doi: 10.1158/0008-5472.CAN-16-0136.
14. Briasoulis E., Aravantinos G., Kouvatseas G. Dose selection trial of metronomic oral vinorelbine monotherapy in patients with metastatic cancer: a hellenic cooperative oncology group clinical translational study. BMC Cancer. 2013;13(1):263. Doi: 10.1186/1471-2407-13-263.
15. Cazzaniga M.E., Munzone E., Bocci G. Pan-European Expert Meeting on the Use of Metronomic Chemotherapy in Advanced Breast Cancer Patients: The PENELOPE Project. Adv Ther. 2019;36(2):381–406. Doi: 10.1007/s12325-018-0844-4.
16. De Iuliis F., Salerno G., Taglieri L., et al. On and off metronomic oral vinorelbine in elderly women with advanced breast cancer. Tumori. 2015;101(1):30–5. Doi:10.5301/tj.5000207.
Метрономная терапия: новый ритм – новые возможности
Клинический научно-практический центр специализированных видов медицинской помощи (онкологический),
Санкт-Петербург, Россия
Современные методы лекарственного лечения онкологических заболеваний приводят к увеличению продолжительности жизни. К сожалению, подобные успехи в большинстве своем характерны для определенной группы больных с учетом специфических предиктивных факторов. С целью преодоления подобной резистентности опухолевых клеток разрабатываются новые стратегии терапии. К ним относится метрономная терапия злокачественных опухолей. Концепция применения метрономной терапии заключается в торможении роста злокачественных клеток, что теоретически снизит вероятность достижения «летального» объема опухоли и тем самым может повлиять на показатели выживаемости.
Введение
На сегодняшний день перспективным методом лекарственного лечения злокачественных новообразований являются стратегии, основанные на поиске и подавлении «триггерных» мишеней с учетом биологии роста опухоли [1]. К ним относятся следующие ингибиторы:
В итоге в арсенале клинического онколога принципиально имеются следующие возможности воздействия на злокачественные клетки: цитостатики, таргетная терапия, иммунотерапия и экспериментальные направления, целью которых служат регуляция метаболизма опухоли и эпигенетическая терапия. В результате подобные методы, безусловно, приводят к увеличению продолжительности жизни. Например, лекарственная терапия современными препаратами увеличивает медиану общей выживаемости больных раком молочной железы (РМЖ) с 32 до 50 месяцев [2],толстой кишки с 5–6 до 30 [3], желудка с 3–5 до 16 [4], легкого с 3,9 до 36 месяцев [5]. С другой стороны, иммунотерапевтические принципы лечения позволяют обсуждать 20%-ную возможность излечения. К сожалению, подобные успехи в большинстве своем характерны для определенной группы больных с учетом специфических предиктивных факторов [6]. В общей популяции подобная тенденция не столь выражена. Это обусловлено многими факторами, к которым относятся особенности кинетики роста, гетерогенность опухолевой популяции, опухолевая эволюция, репопуляция клеток, лекарственная резистентность, микроокружение или опухолевый матрикс, эпигенетические нарушения, тканевая иммуносупрессия, константы гомеостаза (pH, гликемия), стволовые клетки [7]. С целью возможности преодоления подобной резистентности опухолевых клеток разрабатываются новые стратегии терапии. К ним относится метрономная терапия (МТ) злокачественных опухолей. Это один из вариантов dose-dense терапии, в котором химиопрепараты назначаются через определенные короткие промежутки времени (часы, дни, недели) в низких (10–40% от терапевтической) дозах с целью увеличения продолжительности жизни больных неизлечимыми диссеминированными с.
Метрономные режимы химиотерапии в онкологии
Полный текст:
Аннотация
Ключевые слова
Об авторах
Отделение клинической фармакологии и химиотерапии,
115478, Москва, Каширское шоссе, 24
Отделение клинической фармакологии и химиотерапии,
115478, Москва, Каширское шоссе, 24
Отделение клинической фармакологии и химиотерапии,
115478, Москва, Каширское шоссе, 24
Список литературы
1. Hanahan D., Bergers G., Bergsland E. Less is more, regularly: metronomic dosing of cytotoxic drugs can target tumor angiogenesis in mice. J Clin Invest 2000;105(8):1045–7.
2. Browder T., Butterfield C.E., Kräling B.M. et al. Antiangiogenic scheduling of chemotherapy improves efficacy against experimental drug-resistant cancer. Cancer Res 2000;60(7):1878–86.
3. Klement G., Baruchel S., Rak J. et al. Continuous low-dose therapy with vinblastine and VEGF receptor-2 antibody induces sustained tumor regression without overt toxicity. J Clin Invest 2000;105(8):R15–24.
4. Kerbel R.S. Inhibition of tumor angiogenesis as a strategy to circumvent acquired resistance to anti-cancer therapeutic agents. Bioessays 1991;13(1):31–6.
5. Тихановская Н.М., Владимирова Л.Ю., Попова И.Л. Опыт применения препарата сорафениб в лечении генерализованных форм рака печени. Злокачественные опухоли 2013;2(6):155. [Тikhanovskaya N.М., Vladimirovа L.Yu., Popovа I.L. Experience of the application of sorafenib substance in the treatment of generalized forms of the hepatic cancer. Zlokachestvennye opukholi = Malignant Tumors 2013;2(6):155. (In Russ.)].
6. Каприн А.Д., Иванов С.А., Клименко А.А., Добровольская Н.Ю. Пример применения ингибитора тирозинкиназ в качестве таргетной терапии при светлоклеточном варианте рака почки. Злокачественные опухоли 2015;1(12):49–52. [Kaprin А.D., Ivanov S.А., Klimenko А.А., Dobrovol’skaya N.Yu. Example of the application of tyrosine kinase inhibitor as target therapy for the renal cell carcinoma. Zlokachestvennye opukholi = Malignant Tumors 2015;1(12):49–52. (In Russ.)].
7. Клименко А.А., Иванов С.А., Добровольская Н.Ю. Длительное применение бевацизумаба с интерфероном-альфа в качестве первой линии таргетной терапии распространенного рака почки. Злокачественные опухоли 2014;2(9): 37–42. [Klimenko А.А., Ivanov S.А., Dobrovol’skaya N.Yu. Long-term bevatsizumab and interferon alpha application as the first line of the target therapy of the advanced kidney cancer. Zlokachestvennye opukholi = Malignant Tumors 2014;2(9):37–42. (In Russ.)].
8. Bertolini F., Paul S., Mancuso P. et al. Maximum tolerable dose and low-dose metronomic chemotherapy have opposite effects on the mobilization and viability of circulating endothelial progenitor cells. Cancer Res 2003;63(15):4342–6.
9. Shaked Y., Ciarrocchi A., Franco M. et al. Therapy-induced acute recruitment of circulating endothelial progenitor cells to tumors. Science 2006;313(5794):1785–7.
10. Shaked Y., Henke E., Roodhart J.M. et al. Rapid chemotherapy-induced surge in endothelial progenitor cells: implications for antiangiogenic drugs as chemosensitizing agents. Cancer Cell 2008;14(3):263–73.
11. Mitchell M.S. Relapse in the central nervous system in melanoma patients successfully treated with biomodulators. J Clin Oncol 1989;7(11):1701–9.
12. Mokyr M.B., Dray S. Some advantages of curing mice bearing a large subcutaneous MOPC-315 tumor with a low dose rather than a high dose of cyclophosphamide. Cancer Res 1983;43(7):3112–9.
13. Berd D., Maguire H.C. Jr, Mastrangelo M.J. Potentiation of human cell-mediated and humoral immunity by low-dose cyclophosphamide. Cancer Res 1984;44(11):5439–43.
14. Berd D., Mastrangelo M.J. Effect of low dose cyclophosphamide on the immune system of cancer patients: reduction of T-suppressor function without depletion of the CD8+ subset. Cancer Res 1987;47(12):3317–21.
15. Wersäll P., Mellstedt H. Increased LAK and T cell activation in responding renal cell carcinoma patients after low dose cyclophosphamide, IL-2 and alpha-IFN. Med Oncol 1995;12(2):69–77.
16. Pasquier E., Kavallaris M., André N. Metronomic chemotherapy: new rationale for new directions. Nat Rev Clin Oncol 2010;7(8):455–65.
17. Bocci G., Francia G., Man S. et al. Thrombospondin 1, a mediator of the antiangiogenic effects of low-dose metronomic chemotherapy. Proc Natl Acad Sci U S A 2003;100(22):12917–22.
18. Hamano Y., Sugimoto H., Soubasakos M.A. et al. Thrombospondin-1 associated with tumor microenvironment contributes to lowdose cyclophosphamide-mediated endothelial cell apoptosis and tumor growth suppression. Cancer Res 2004;64(5):1570–4.
19. Rapisarda A., Zalek J., Hollingshead M. et al. Schedule-dependent inhibition of hypoxia- inducible factor-1alpha protein accumulation, angiogenesis, and tumor growth by topotecan in U251-HRE glioblastoma xenografts. Cancer Res 2004;64(19):6845–8.
20. Rapisarda A., Uranchimeg B., Sordet O. et al. Topoisomerase I-mediated inhibition of hypoxia-inducible factor 1: mechanism and therapeutic implications. Cancer Res 2004;64(4):1475–82.
21. Rapisarda A., Hollingshead M., Uranchimeg B. et al. Increased antitumor activity of bevacizumab in combination with hypoxia inducible factor-1 inhibition. Mol Cancer Ther 2009;8(7):1867–77.
22. Lee K., Qian D.Z., Rey S. et al. Anthracycline chemotherapy inhibits HIF-1 transcriptional activity and tumor-induced mobilization of circulating angiogenic cells. Proc Natl Acad Sci U S A 2009;106(7):2353–8.
23. Man S., Bocci G., Francia G. et al. Antitumor and anti-angiogenic effects in mice of low-dose (metronomic) cyclophosphamide administered continuously through the drinking water. Cancer Res 2002;62(10):2731–5.
24. Shaked Y., Cervi D., Neuman M. et al. The splenic microenvironment is a source of angiogenesis/inflammatory mediators accelerating the extramedullary expansion of murine erythroleukemic cells. Blood 2005;105(11):4500–7.
25. Shaked Y., Emmengger U., Man S. et al. Optimal biologic dose of metronomic chemotherapy regimens is associated with maximum antiangiogenic activity. Blood 2005;106(9):3058–61.
26. Shaked Y., Bertolini F., Man S. et al. Genetic heterogeneity of the vasculogenic phenotype parallels angiogenesis: implications for cellular surrogate marker analysis of antiangiogenesis. Cancer Cell 2005;7(1):101–11.
27. Farace F., Massard C., Borghi E. et al. Vascular disrupting therapy-induced mobilization of circulating endothelial progenitor cells. Ann Oncol 2007;18(8):1421–2.
28. Daenen L.G., Shaked Y., Man S. et al. Low-dose metronomic cyclophosphamide combined with vascular disrupting therapy induces potent antitumor activity in preclinical human tumor xenograft models. Mol Cancer Ther 2009;8(10):2872–81.
29. Mancuso P., Colleoni M., Calleri A. et al. Circulating endothelial-cell kinetics and viability predict survival in breast cancer patients receiving metronomic chemotherapy. Blood 2006;108(2):452–9.
30. Noberasco C., Spitaleri G., Mancuso P. et al. Safety, tolerability and biological effects of long-term metronomic administration of non-cytotoxic anti-angiogenic agents. Oncology 2009;77(6):358–65.
31. Shao Y.Y., Lin Z.Z., Chen T.J. et al. High circulating endothelial progenitor levels associated with poor survival of advanced hepatocellular carcinoma patients receiving sorafenib combined with metronomic chemotherapy. Oncology 2011;81(2):98–103.
32. Ghiringhelli F., Larmonier N., Schmitt E. et al. CD4+CD25+ regulatory T cells suppress tumor immunity but are sensitive to cyclophosphamide which allows immunotherapy of established tumors to be curative. Eur J Immunol 2004;34(2):336–44.
33. Ghiringhelli F., Menard C., Puig P.E. et al. Metronomic cyclophosphamide regimen selectively depletes CD4+CD25+ regulatory T cells and restores T and NK effector functions in end stage cancer patients. Cancer Immunol Immunother 2007;56(5):641–8.
34. Rozados V.R., Mainetti L.E., Rico M.J. et al. The immune response and the therapeutic effect of metronomic chemotherapy with cyclophosphamide. Oncol Res 2010; 18(11–12):601–5.
35. Doloff J.C., Waxman D.J. VEGF receptor inhibitors block the ability of metronomically dosed cyclophosphamide to activate innate immunity-induced tumor regression. Cancer Res 2012;72(5):1103–15.
36. НовикА.В., КомаровЮ.И., ПроценкоС.А. и др. Применение ипилимумаба у больных диссеминированной меланомой кожи. Злокачественные опухоли 2014;3(10):60–3. [Novik А.V., Komarov Yu.I., Protsenko S.А. et al. Ipilimubab application at patients with disseminated skin melanoma. Zlokachestvennye opukholi = Malignant Tumors 2014;3(10):60–3. (In Russ.)].
37. Кадагидзе З.Г., Черткова А.И., Заботина Т.Н. и др. Новые возможности регуляции противоопухолевого иммунного ответа. Злокачественные опухоли 2015;1(12):24–30. [Kadagidze Z.G., Chertkovа А.I., Zabotinа Т.N. et al. New opportunities of the antitumoral immune response. Zlokachestvennye opukholi = Malignant Tumors 2015;1(12):24–30. (In Russ.)].
38. Cruz-Muñoz W., Di Desidero T., Man S. et al. Analysis of acquired resistance to metronomic oral topotecan chemotherapy plus pazopanib after prolonged preclinical potent responsiveness in advanced ovarian cancer. Angiogenesis 2014;17(3):661–73.
39. Hashimoto K., Man S., Xu P. et al. Potent preclinical impact of metronomic low-dose oral topotecan combined with the antiangiogenic drug pazopanib for the treatment of ovarian cancer. Mol Cancer Ther 2010;9(4):996–1006.
40. Munoz R., Man S., Shaked Y. et al. Highly efficacious nontoxic preclinical treatment for advanced metastatic breast cancer using combination oral UFT-cyclophosphamide metronomic chemotherapy. Cancer Res 2006;66(7):3386–91.
41. Francia G., Cruz-Munoz W., Man S. et al. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nat Rev Cancer 2011;11(2):135–41.
42. Cruz-Munoz W., Man S., Xu P., Kerbel R.S. Development of a preclinical model of spontaneous human melanoma central nervous system metastasis. Cancer Res 2008;68(12): 4500–5.
43. Hackl C., Man S., Francia G. et al. Metronomic oral topotecan prolongs survival and reduces liver metastasis in improved preclinical orthotopic and adjuvant therapy colon cancer models. Gut 2013;62(2):259–71.
44. Hurwitz H., Fehrenbacher L., Novotny W. et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004;350(23):2335–42.
45. Guerin E., Man S., Xu P., Kerbel R.S. A model of postsurgical advanced metastatic breast cancer more accurately replicates the clinical efficacy of antiangiogenic drugs. Cancer Res 2013;73(9):2743–8.
46. Pietras K., Hanahan D. A multitargeted, metronomic, and maximum-tolerated dose “chemo-switch” regimen is antiangiogenic, producing objective responses and survival benefit in a mouse model of cancer. J Clin Oncol 2005;23(5):939–52.
47. Folkins C., Man S., Xu P. et al. Anticancer therapies combining antiangiogenic and tumor cell cytotoxic effects reduce the tumor stemlike cell fraction in glioma xenograft tumors. Cancer Res 2007;67(8):3560–4.
48. Martin-Padura I., Marighetti P., Agliano A. et al. Residual dormant cancer stem-cell foci are responsible for tumor relapse after antiangiogenic metronomic therapy in hepatocellular carcinoma xenografts. Lab Invest 2012;92(7):952–66.
49. Beck B., Driessens G., Goossens S. et al. A vascular niche and a VEGF-Nrp1 loop regulate the initiation and stemness of skin tumours. Nature 2011;478(7369):399–403.
50. Shaked Y., Tang T., Woloszynek J. et al. Contribution of granulocyte colony-stimulating factor to the acute mobilization of endothelial precursor cells by vascular disrupting agents. Cancer Res 2009;69(19):7524–8.
51. Bellmunt J., Trigo J.M., Calvo E. et al. Activity of a multitargeted chemo-switch regimen (sorafenib, gemcitabine, and metronomic capecitabine) in metastatic renal-cell carcinoma: a phase 2 study (SOGUG-02-06). Lancet Oncol 2010;11(4):350–7.
52. Calabrese C., Poppleton H., Kocak M. et al. A perivascular niche for brain tumor stem cells. Cancer Cell 2007;11(1):69–82.
53. Benayoun L., Gingis-Velitski S., Voloshin T. et al. Tumor-initiating cells of various tumor types exhibit differential angiogenic properties and react differently to antiangiogenic drugs. Stem Cells 2012;30(9):1831–41.
54. Vives M., Ginesta M.M., Gracova K. et al. Metronomic chemotherapy following the maximum tolerated dose is an effective anti-tumor therapy affecting angiogenesis, tumor differentiation and cancer stem cells. Int J Cancer 2013;133(10):2464–72.
55. Fontana A., Galli L., Fioravanti A. et al. Clinical and pharmacodynamic evaluation of metronomic cyclophosphamide, celecoxib, and dexamethasone in advanced hormonerefractory prostate cancer. Clin Cancer Res 2009;15(15):4954–62.
56. Loven D., Be’ery E., Yerushalmi R. et al. Daily low-dose/continuous capecitabine combined with neo-adjuvant irradiation reduces VEGF and PDGF-BB levels in rectal carcinoma patients. Acta Oncol 2008;47(1):104–9.
57. Colleoni M., Orlando L., Sanna G. et al. Metronomic low-dose oral cyclophosphamide and methotrexate plus or minus thalidomide in metastatic breast cancer: antitumor activity and biological effects. Ann Oncol 2006;17(2):232–8.
58. Lansiaux A., Salingue S., Dewitte A. et al. Circulating thrombospondin 1 level as a surrogate marker in patients receiving cyclophosphamide-based metronomic chemotherapy. Invest New Drugs 2012;30(1):403–4.
59. Kamat A.A., Kim T.J., Landen C.N. Jr et al. Metronomic chemotherapy enhances the efficacy of antivascular therapy in ovarian cancer. Cancer Res 2007;67(1):281–8.
60. Kim J.T., Kim J.S., Ko K.W. et al. Metronomic treatment of temozolomide inhibits tumor cell growth through reduction of angiogenesis and augmentation of apoptosis in orthotopic models of gliomas. Oncol Rep 2006;16(1):33–9.
61. Francia G., Shaked Y., Hashimoto K. et al. Low-dose metronomic oral dosing of a prodrug of gemcitabine (LY2334737) causes antitumor effects in the absence of inhibition of systemic vasculogenesis. Mol Cancer Ther 2012;11(3):680–9.
62. Murray A., Little S.J., Stanley P. et al. Sorafenib enhances the in vitro anti-endothelial effects of low dose (metronomic) chemotherapy. Oncol Rep 2010;24(4):1049–58.
63. Naganuma Y., Choijamts B., Shirota K. et al. Metronomic doxifl uridine chemotherapy combined with the anti-angiogenic agent TNP-470 inhibits the growth of human uterine carcinosarcoma xenografts. Cancer Sci 2011;102(8):1545–52.
64. Kumar S., Mokhtari R.B., Sheikh R. et al. Metronomic oral topotecan with pazopanib is an active antiangiogenic regimen in mouse models of aggressive pediatric solid tumor. Clin Cancer Res 2011;17(17):5656–67.
65. Merritt W.M., Nick A.M., Carroll A.R. et al. Bridging the gap between cytotoxic and biologic therapy with metronomic topotecan and pazopanib in ovarian cancer. Mol Cancer Ther 2010;9(4):985–95.
66. Hashimoto K., Man S., Xu P. et al. Potent preclinical impact of metronomic low-dose oral topotecan combined with the antiangiogenic drug pazopanib for the treatment of ovarian cancer. Mol Cancer Ther 2010;9(4):996–1006.
67. Tas F., Duranyildiz D., Soydinc H.O. et al. Effect of maximum-tolerated doses and lowdose metronomic chemotherapy on serum vascular endothelial growth factor and thrombospondin-1 levels in patients with advanced nonsmall cell lung cancer. Cancer Chemother Pharmacol 2008;61(5):721–5.
68. Колядина И.В., Поддубная И.В., Франк Г.А. и др. Гетерогенность рака молочной железы I стадии: биологическое и прогностическое значение. Злокачественные опухоли 2015;1(12): 31–41. [Kolyadina I.V., Poddubnaya I.V., Frank G.А. et al. Heterogeneity of the I stage of the mammary gland cancer: biologic and prognostic value. Zlokachestvennye opukholi = Malignant Tumors 2015;1(12): 31–41. (In Russ.)].
69. Муфазалов Ф.Ф., Шарипова Н.С. Тройной негативный рак молочной железы: современное состояние проблемы и не совсем обычный случай лечения. Злокачественные опухоли 2014;1(8):19–31. [Мufazalov F.F., Sharipovа N.S. Тriple negative mammary gland cancer: modern status of the problem and weird treatment case study. Zlokachestvennye opukholi = Malignant Tumors 2014;1(8):19–31. (In Russ.)].
70. Дементьева Н.А. Васкулоэндотелиальный фактор роста (VEGF) и новообразования сосудистого генеза у детей. Злокачественные опухоли 2013;2(6):181–2. [Dement’evа N.А. Vasculo-endothelium growth factor (VEGF) and vascular genesis neoplasia at children. Zlokachestvennye opukholi = Malignant Tumors 2013;2(6): 181–2. (In Russ.)].
71. Shahrzad S., Shirasawa S., Sasazuki T. et al. Low-dose metronomic cyclophosphamide treatment mediates ischemia-dependent K-ras mutation in colorectal carcinoma xenografts. Oncogene 2008;27:3729–38.
72. Nagasubramanian R., Dolan M.E. Temozolomide: realizing the promise and potential. Curr Opin Oncol 2003;15(6):412–8.
73. Vera K., Djafari L., Faivre S. et al. Dosedense regimen of temozolomide given every other week in patients with primary central nervous system tumors. Ann Oncol 2004;15(1):161–71.
74. Payne M.J., Pratap S.E., Middleton M.R. Temozolomide in the treatment of solid tumours: current results and rationale for dosing/scheduling. Crit Rev Oncol Hematol 2005;53(3):241–52.
75. Pan Q., Yang X.J., Wang H.M. et al. Chemoresistance to temozolomide in human glioma cell line U251 is associated with increased activity of O6-methylguanine-DNA methyltransferase and can be overcome by metronomic temozolomide regimen. Cell Biochem Biophys 2012;62(1):185–91.
76. Zhou Q., Guo P., Wang X. et al. Preclinical pharmacokinetic and pharmacodynamic evaluation of metronomic and conventional temozolomide dosing regimens. J Pharmacol Exp Ther 2007;321(1):265–75.
77. Banissi C., Ghiringhelli F., Chen L., Carpentier A.F. Treg depletion with a low-dose metronomic temozolomide regimen in a rat glioma model. Cancer Immunol Immunother 2009;58(10):1627–34.
78. Ma L., Francia G., Viloria-Petit A. et al. In vitro procoagulant activity induced in endothelial cells by chemotherapy and antiangiogenic drug combinations: modulation by lower-dose chemotherapy. Cancer Res 2005;65(12):5365–73.
79. Boven E., Schipper H., Erkelens C.A. et al. The influence of the schedule and the dose of gemcitabine on the anti-tumour efficacy in experimental human cancer. Br J Cancer 1993;68(1):52–6.
80. Jia L., Zhang M.H., Yuan S.Z., Huang W.G. Antiangiogenic therapy for human pancreatic carcinoma xenografts in nude mice. World J Gastroenterol 2005;11(3):447–50.
81. Pratt S.E., Durland-Busbice S., Shepard R.L. et al. Efficacy of low-dose oral metronomic dosing of the prodrug of gemcitabine, LY2334737, in human tumor xenografts. Mol Cancer Ther 2013;12(4):481–90.
82. Копп М.В., Королева И.А. Адъювантная и неоадъювантная терапия опухолей желудочно-кишечного тракта. Злокачественные опухоли 2013;2(6):33–42. [Kopp М.V., Korolevа I.А. Аdjuvant and non-adjuvant therapy of gastro-intestinal tract tumors. Zlokachestvennye opukholi = Malignant Tumors 2013;2(6):33–42. (In Russ.)].
83. Гарин А.М. Значимый прогресс в решении проблемы рака толстой кишки. Злокачественные опухоли 2012;2(2):46–8. [Garin А.М. Significant progress in the solution of the colon cancer problem. Zlokachestvennye opukholi = Malignant Tumors 2012;2(2):46–8. (In Russ.)].
84. Drevs J., Fakler J., Eisele S. et al. Antiangiogenic potency of various chemotherapeutic drugs for metronomic chemotherapy. Anticancer Res 2004;24(3a):1759–63.
85. Lamont E.B., Schilsky R.L. The oral fluoropyrimidines in cancer chemotherapy. Clin Cancer Res 1999;5(9):2289–96.
86. Tang T.C., Man S., Xu P. et al. Development of a resistance-like phenotype to sorafenib by human hepatocellular carcinoma cells is reversible and can be delayed by metronomic UFT chemotherapy. Neoplasia 2010;12(11):928–40.
87. Zhang Q., Kang X., Yang B. et al. Antiangiogenic effect of capecitabine combined with ginsenoside Rg3 on breast cancer in mice. Cancer Biother Radiopharm 2008;23(5): 647–53.
88. Ooyama A., Oka T., Zhao H.Y. et al. Antiangiogenic effect of 5-Fluorouracil-based drugs against human colon cancer xenografts. Cancer Lett 2008;267(1):26–36.
89. Iwamoto H., Torimura T., Nakamura T. et al. Metronomic S-1 chemotherapy and vandetanib: an efficacious and nontoxic treatment for hepatocellular carcinoma. Neoplasia 2011;13(3):187–97.
90. Belotti D., Vergani V., Drudis T. et al. The microtubule-affecting drug paclitaxel has antiangiogenic activity. Clin Cancer Res 1996;2(11):1843–9.
91. Vacca A., Iurlaro M., Ribatti D. et al. Antiangiogenesis is produced by nontoxic doses of vinblastine. Blood 1999;94(12):4143–55.
92. Hayot C., Farinelle S., De Decker R. et al. In vitro pharmacological characterizations of the anti-angiogenic and anti-tumor cell migration properties mediated by microtubuleaffecting drugs, with special emphasis on the organization of the actin cytoskeleton. Int J Oncol 2002;21(2):417–25.
93. Bocci G., Nicolaou K.C., Kerbel R.S. Protracted low-dose effects on human endothelial cell proliferation and survival in vitro reveal a selective antiangiogenic window for various chemotherapeutic drugs. Cancer Res 2002;62(23):6938–43.
94. Pourroy B., Honore S., Pasquier E. et al. Antiangiogenic concentrations of vinflunine increase the interphase microtubule dynamics and decrease the motility of endothelial cells. Cancer Res 2006;66(6):3256–63.
95. Pasquier E., Honore S., Pourroy B. et al. Antiangiogenic concentrations of paclitaxe l induce an increase in microtubule dynamics in endothelial cells but not in cancer cells. Cancer Res 2005;65(6):2433–40.
96. Saltz L.B., Clarke S., Díaz-Rubio E. et al. Bevacizumab in combination with oxaliplatin based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 2008;26(12):2013–9.
97. van Cutsem E., Tabernero J., Lakomy R. et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol 2012;30(28):3499–506.
98. Grothey A., van Cutsem E., Sobrero A. et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013;381(9863):303–12.
99. Tabernero J., Cohn A.L., Obermannova R. et al. RAISE: A randomized, double-blind, multicenter phase III study of irinotecan, folinic acid, and 5-fluorouracil (FOLFIRI) plus ramucirumab (RAM) or placebo (PBO) in patients (pts) with metastatic colorectal carcinoma (CRC) progressive during or following first-line combination therapy with bevacizumab (bev), oxaliplatin (ox), and a fluoropyrimidine (fp). J Clin Oncol 2015;33(suppl 3; abstr 512).
100. Bocci G., Falcone A., Fioravanti A. et al. In vitro and in vivo antiangiogenic and antitumour effects of metronomic irinotecan on colorectal cancer. 33rd Italian Society of Pharmacology Meeting. June 2007. Cagliari, Italy.
101. Chen H.X., Mooney M., Boron M. et al. Phase II multicenter trial of bevacizumab plus fluorouracil and leucovorin in patients with advanced refractory colorectal cancer: an NCI Treatment Referral Center Trial TRC-0301. J Clin Oncol 2006;24(21):3354–60.
102. Allegrini G., Falcone A., Fioravanti A. et al. A pharmacokinetic and pharmacodynamic study on metronomic irinotecan in metastatic colorectal cancer patients. Br J Cancer 2008;98(8):1312–9.
103. Young S.D., Whissell M., Noble J.C. et al. Phase II clinical trial results involving treatment with low-dose daily oral cyclophosphamide, weekly vinblastine, and rofecoxib in patients with advanced solid tumors. Clin Cancer Res 2006;12(10):3092–8.
104. Allegrini G., Di Desidero T., Barletta M.T. et al. Clinical, pharmacokinetic and pharmacodynamic evaluations of metronomic UFT and cyclophosphamide plus celecoxib in patients with advanced refractory gastrointestinal cancers. Angiogenesis 2012;15(2):275–86.
105. Penel N., Clisant S., Dansin E. et al. Megestrol acetate versus metronomic cyclophosphamide in patients having exhausted all effective therapies under standard care. Br J Cancer 2010;102(8):1207–12.
106. Marmorino F., Cremolini C., Loupakis F. et al. Metronomic capecitabine (cape) and cyclophosphamide (CTX) for refractory metastatic colorectal cancer (mCRC): results of a phase II trial. J Clin Oncol 2013; 31(Suppl):abstr e14577.
107. Koopman M., Simkens L.H.J., Tije A.J.T. et al. Maintenance treatment with capecitabine and bevacizumab versus observation after induction treatment with chemotherapy and bevacizumab in metastatic colorectal cancer (mCRC): The phase III CAIRO3 study of the Dutch Colorectal Cancer Group (DCCG). J Clin Oncol 2013;31(suppl; abstr 3502).
108. Salvatore L., Loupakis F., Cremolini C. et al. Phase II randomized study of induction FOLFOXIRI plus bevacizumab (bev) followed by maintenance with bev alone or bev plus metronomic chemotherapy (metroCT) in metastatic colorectal cancer (mCRC): The MOMA trial. J Clin Oncol 32:5s, 2014 (suppl; abstr TPS3664).
109. Carreca I.U., Bellomo F., Burgio S.L. et al. Metronomic therapy irinotecan (IRI) capecitabine (CAP) plus bevacizumab (BEV) in treatment of advanced colorectal cancer (ACRC) in very elderly people. J Clin Oncol 2010;28(suppl; abstr 3552):15s.
110. Kelley R.K., Ko A.H., Kofler E. et al. Phase I trial of metronomic cyclophosphamide (CTX), bevacizumab (BV), and imatinib (IM) in patients (pts) with metastatic colorectal cancer (mCRC). 2009 Gastrointestinal Cancers Symposium, abs 360.
111. Moiseyenko V., Chubenko V., Protsenko S. et al. Phase II study of metronomic chemotherapy (MC) with irinotecan (CPT-11) in patients with refractory metastatic colorectal cancer (MCRC). J Clin Oncol 2010;28(suppl; abstr e14109).
112. Carreca I.U., Bellomo F.M., Pernice G. et al. Metronomic (M), capecitabine (C), and oxaliplatin (O) plus bevacizumab (B) as treatment of advanced colorectal cancer (ACRC) in very elderly people (M-COB): Efficacy and safety (E&S) evaluation — A 2-year monitoring. J Clin Oncol 2011;29(suppl; abstr e14086).
113. Chubenko V., Protsenko S., Mikhalychenko T. et al. Non-randomized phase II study comparing metronomic regimens of chemotherapy in patients (pts) with refractory metastatic colorectal cancer (mCRC). Ann Oncol 2010;21(Suppl 8).
114. Федянин М.Ю. Персонализированная терапия в онкологии: настоящее и будущее. Злокачественные опухоли 2012;2(2):106–10. [Fedyanin М.Yu. Personalized therapy in oncology: present and future. Zlokachestvennye opukholi = Malignant Tumors 2012;2(2):106–10. (In Russ.)].
Для цитирования:
Федянин М.Ю., Покатаев И.А., Тюляндин С.А. Метрономные режимы химиотерапии в онкологии. Тазовая хирургия и онкология. 2016;6(1):27-35. https://doi.org/10.17650/2220-3478-2016-6-1-27-35
For citation:
Fedyanin M.Yu., Pokataev I.A., Tyulyandin S.A. Metronomic chemotherapy regimens in oncology. Pelvic Surgery and Oncology. 2016;6(1):27-35. (In Russ.) https://doi.org/10.17650/2220-3478-2016-6-1-27-35