медикаментозная субкомпенсация что это такое
Что такое гипотиреоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Курашова О. Н., терапевта со стажем в 27 лет.
Определение болезни. Причины заболевания
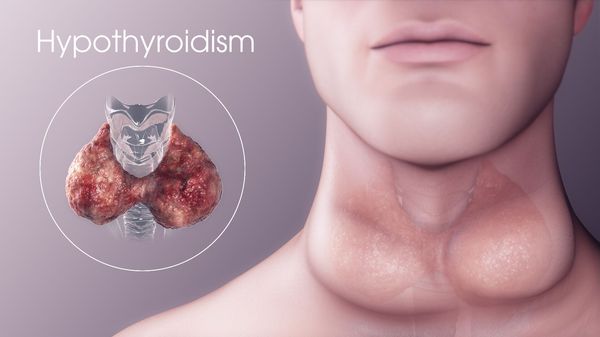
Гипотиреоз — это заболевание эндокринной системы, возникающее из-за длительно низкого уровня тиреоидных гормонов, вырабатываемых щитовидной железой, и проблем с их воздействием на организм преимущественно на тканевом уровне.
Ежегодно на каждую тысячу человек приходится 0,6-3,5% заболевших гипотиреозом. [3] [6] [8] Данное нарушение может возникнуть в любом возрасте, но обычно оно возникает у пожилых людей старше 60 лет. [14] Среди новорождённых гипотиреоз встречается в одном случае из 4-5 тысяч.
К факторам риска относятся:
В 80% случаев гипотиреоз связан с поражением защитных сил организма, т. е. аутоиммунным тиреоидитом. Он является ведущей причиной первичного гипотиреоза у взрослых людей. [3]
Риск возникновения аутоиммунного тиреоидита зависит от возраста и пола пациента: у женщин в возрасте 40-50 лет он возникает в 10-15 раз чаще, чем у мужчин. [6] [9]
При аутоиммунном тиреоидите даже на фоне длительной ремиссии функциональное состояние щитовидной железы в разное время может значительно различаться. Так, с возрастом деструктивные изменения в щитовидной железе постепенно нарастают. Этот фактор, а также наличие тиреоидных аутоантител могут спровоцировать переход субклинического (скрытого) гипотиреоза, протекающего на фоне аутоиммунного тиреоидита, в явный. Частота таких случаев составляет около 5 % в год.
Симптомы гипотиреоза
Симптомы гипотиреоза крайне обманчивы, разнообразны и не всегда заметны. Их проявление зависит от степени выраженности заболевания.
К основным клиническим проявлениям относятся: [9] [11] [14]
Патогенез гипотиреоза
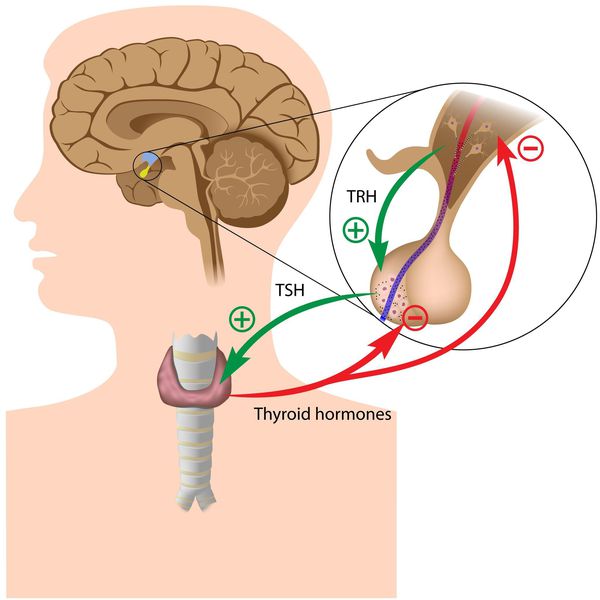
Тиреоидные гормоны, которые вырабатывает щитовидная железа, называются «трийодтиронин» (Т3) и «тироксин» (Т4). Они влияют практически на все процессы, протекающие в организме. Стимулирующее влияние на них оказывает тиреотропный гормон гипофиза (ТТГ).
Синтез тиреоидных гормонов начинается после того, как щитовидная железа захватывает йод. Он является регулятором гормоногенеза и размножения тиреоцитов — клеток эпителия щитовидной железы. Попав в тиреоциты, йодид окисляется до активной формы при помощи тиреопероксидазы — микросомального антигена, к которому образуются антитела, в частности при аутоиммунном тиреоидите. [4] [6] [7] Уровень поступления йода изменяет чувствительность тиреоцитов к воздействию ТТГ, которая усиливается при дефиците йода. [3] [6]
Исходя из этого механизма возникновения гормонов щитовидной железы, патогенетически гипотиреоз делится на три типа:
Первичный гипотиреоз возникает в 80-95% случаев и чаще всего обусловлен нарушениями общей структуры щитовидной железы, которые являются врождёнными или приобретёнными, а также сбоем секреторной функции её клеток.
Вторичный и третичный гипотиреоз возникают в 3-4% случаев. Они связаны с заболеваниями таких участков головного мозга, как аденогипофиз или гипоталамус в результате которых наблюдается стойкая нехватка гормонов щитовидной железы и нарушение секреции ТТГ гипофиза. [4] [6]
Периферический гипотиреоз развивается крайне редко — в 0-1% случаев. Основным фактором его возникновения является резистентность (сопротивляемость) тканей-мишеней (например, мозга, гипофиза, сердца, костей, печени) гормонам Т4 и Т3. [5] [6] [7]
В патогенезе аутоиммунных заболеваний щитовидной железы взаимодействуют генетические и средовые факторы. Однако точная роль тех и других не определена. Ведущее значение в гибели тиреоцитов при этих заболеваниях придают клеточным механизмам, т.е. цитотоксическим эффектам аутореактивных Т- лимфоцитов. [3] [5] Отсутствие при аутоиммунных поражениях щитовидной железы классических признаков гнойного воспаления (боли, отёка и других), обычно сопровождающих массивный некроз ткани, указывает в таких случаях на иной механизм гибели тиреоцитов. В последние годы установлено, что Т-лимфоциты способны вызывать гибель клеток-мишеней не только путём некроза, но в основном путём индукции их разрушения. [3] [5] [7] [9]
Классификация и стадии развития гипотиреоза
В Международной классификации болезней десятого пересмотра выделены две формы гипотиреоза:
Первичный гипотиреоз подразделят на три большие группы:
В последнее время разработана классификация первичного гипотиреоза, которая основывается на выраженности симптомов и результатах гормональных исследований (определяющий показатель — уровень ТТГ). В неё включают:
Осложнения гипотиреоза
Гипотиреоидная кома («спячка») — это угрожающее жизни состояние, которое чаще развивается у пожилых людей, которые долгое время не лечили тяжёлый гипотиреоз, который был у них довольно долгое время. [3] [5] [7] [9]
К основным провоцирующим факторам такого осложнения относят:
Но появление осложнений может вызвать не только отсутствие лечения, но и неграмотная медикаментозная терапия. Например, передозировка лекарствами может привести к избыточному синтезу гормонов щитовидной железы и патологиям со стороны сердечно-сосудистой системы. В связи с этим крайне важно соблюдать все рекомендации врача по лечению заболевания и ни в коем случае не лечиться самостоятельно.
Диагностика гипотиреоза
Диагностика гипотиреоза включает в себя подробный опрос пациента, осмотр и лабораторные исследования.
Так как симптомы гипотиреоза неспецифичны, он может скрываться под масками других заболеваний. Поэтому по проявлениям его иногда можно спутать с железодефицитной анемией, депрессией, аменореей, невритом и другими нарушениями. [15] [16] В связи с этим важную роль в определении гипотиреоза играют лабораторные исследования. Они показаны всем пациентам с нарушениями щитовидной железы и предполагают оценку уровня ТТГ и свободного Т4. [2] [12] Определение уровня Т3 в крови, как правило, не является информативным, так как при первичном гипотиреозе этот показатель находится в норме. [14]
На явное наличие гипотиреоза будет указывать высокий уровень ТТГ и низкий уровень свободного Т4 в крови. При субклиническом гипотиреозе уровень ТТГ также будет повышен, а уровень свободного Т4 будет находиться в пределах нормы.
После того как наличие гипотиреоза подтверждено, при помощи показателя ТТГ также определяется характер заболевания и наличие возможных осложнений. Уровень ТТГ также позволяет в значительном большинстве случаев оценить адекватность проводимой терапии: об этом будет свидетельствовать стойкий уровень ТТГ в крови в пределах нормы. [6] [7] [8]
В достаточно редких случаях проводят пробу с тиреолиберином для оценки аутоиммунных заболеваний щитовидной железы. [6] [9] [15]
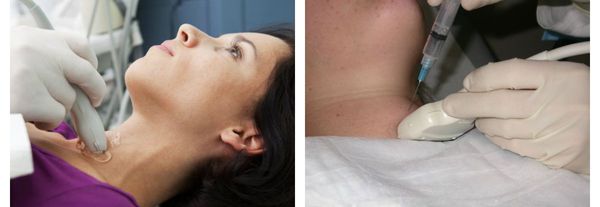
Дополнительные методы диагностики, такие как УЗИ щитовидной железы, сцинтиграфия или пункционная биопсия, используются для уточнения характера и степени выраженности заболевания. [6] [11] [12] [16]
Так как с возрастом учащаются случаи узлового зоба, выраженный шейный кифоз может смещать трахею кзади и вниз, что затрудняет пальпаторную оценку состояния щитовидной железы, в результате чего своевременная диагностика заболевания не проводится. [4] [5] [6] [7] [8]
В связи с тем, что гипотиреоз не всегда проявляет себя, среди населения принято проводить массовую диагностику данного заболевания — скрининг. Так, определение уровня ТТГ позволяет обнаружить первичный гипотиреоз у людей без каких-либо других его проявлений, а также у новорождённых (исследование проводится на 4-5 сутки жизни). При планировании беременности и на ранних её сроках также важно пройти исследование на гипотиреоз. [3] [5] [7] [9]
Лечение гипотиреоза
Цель лечения гипотиреоза — это поддержание уровня ТТГ в пределах 0,5-1,5 мМЕ/л.
Единственным методом лечения является пожизненная заместительная терапия. Начинать её стоит при уровне ТТГ более 10 мЕД/л, высоких титрах антител к ТПО и других показателях. Для этого предпочтительны препараты левотироксина натрия. Его применение противопоказано лишь в случае нелеченого тиреотоксикоза и недостаточности коры надпочечников, остром инфаркте миокарда, аллергии и индивидуальной непереносимости препарата. [16]
Обычно лечение проводится в условиях стационара. Показаниями к госпитализации пациентов с гипотиреозом служат:
Заместительная терапия первичного (манифестного) гипотиреоза показана пожизненно с назначением тироксина в средней дозе 1,6-1,8 мкг/кг. Пациентам с кардиальной патологией доза рассчитывается, исходят из расчёта 0,9 мкг/кг. Стоит отметить, что в связи с уменьшением метаболизма тиреоидных гормонов потребность в них с возрастом снижается. [5] [7] [9]
Дозы тироксина зависят от причин и патогенеза заболевания. Потребность в препарате у людей со спонтанным гипотиреозом выше, чем у пациентов с гипотиреозом, возникшим после хирургического лечения и применения радиоактивного йода.
Уровень ТТГ при диагностике гипотиреоза напрямую связан с оптимальной заместительной дозой тироксина: у большинства женщин она составляет 75-100 мкг, а у мужчин — до 150 мкг в день приёма.
Первый контроль уровня ТТГ после начатого лечения проводят через 2-3 месяца, затем один раз в шесть месяцев (при обязательном условии соблюдения пациентом схемы лечения). [6] [9] [13]
При субклиническом гипотиреозе существует риск развития манифестной формы заболевания со всеми характерными проявлениями. Так, явный гипотиреоз возникает у 20-50% пациентов в течение 4-8 лет, а присутствие антитиреоидных антител увеличивает риск до 80%. [8] [9] [10] Потому людям со скрытым гипотиреозом следует длительно наблюдаться у специалистов.
Проблемы при лечении гипотиреоза
Лечение тироксином безопасно, просто и сравнительно дешево. Но, несмотря на многолетний опыт его использования, при нём всё же могут возникать многие проблемы. Основная из них связана с несоблюдением пациента схемы лечения. Так, одновременное повышение уровней Т4 и ТТГ, по всей вероятности, будет указывать на то, что за несколько дней до визита к врачу пациент не выполнял его назначений.
Снижение эффективности установленной дозы тироксина часто связано с меньшим содержанием гормона в таблетках (например, в непатентованных препаратах) или взаимодействием лекарств при одновременном приёме других препаратов. [9] [13]
Недостаточность дозы также может быть связана с уменьшением всасывания тироксина, нарушением энтеропечёночного кровотока, ускорением кругооборота или выделением гормона с мочой, медленным снижением тиреоидной функции после лечения гипертиреоза.
Существуют и другие особенности и проблемы при лечении гипотиреоза. [6]
Лучшим критерием подбора дозы тироксина при аутоиммунном тиреоидите является исследование ТТГ и свободного Т4. При этом лечение нацелено на компенсацию гипотиреоза благодаря той же заместительной терапии и редукция зоба при помощи супрессивной терапии. [6] [9] Критериями эффективности лечения при этом будут служить:
Назначение препаратов тиреогормонов при аутоиммунном тиреоидите без нарушения функции щитовидной железы нецелесообразно, а операция может привести к состоянию, способному значительно ухудшить качество жизни пациента с возможностью развития тяжёлого гипотиреоза и инвалидизации. [9] [13]
Прогноз. Профилактика
Прогноз заболевания при своевременной диагностике и лечении благоприятный. [10] Осложнить его, особенно в отношении трудоспособности и состояния здоровья в целом, могут фибрилляция предсердий и выраженная сердечная недостаточность, развивающиеся на фоне тиреотоксикоза. [5]
В качестве неспецифической профилактики патологий щитовидной железы стоит проходить санаторно-курортное лечение по показаниям врача.
Доказано, что медикаментозная терапия при гипотиреозе становится более эффективной в сочетании с радоновыми процедурами, а азотные ванны, не содержащие радон, оказывают профилактическое воздействие. [1] [5] Благодаря этому удаётся добиться стойкости ремиссии заболевания.
Рекомендуется проведение до трёх курсов таких процедур с интервалом от 8 до 12 месяцев. Подбор схем лечения в санатории (в т.ч. медикаментозных), рациональное использование природных и климатических факторов определяют ближайший и отдалённый результат оздоровления.
Самый редкий вид дружбы — дружба с собственной головой… Современные подходы к терапии хронического нарушения мозгового кровообращения
Опубликовано в журнале:
Амбулаторный прием / Т. 3. № 1 (7), 2017
А. Л. Вёрткин, А. У. Абдуллаева
Московский государственный медико-стоматологический университет имени А. И. Евдокимова
С годами проблема терапии хронических нарушений мозгового кровообращения приобретает все большую актуальность. Статья посвящена оценке эффективности применения одной из наиболее перспективных групп нейропротекторов — препаратов на основе янтарной кислоты — и ее отечественному представителю Цитофлавину.
Ключевые слова: цереброваскулярные заболевания, хроническая недостаточность мозгового кровообращения, артериальная гипертензия, атеросклероз, Цитофлавин.
Цереброваскулярные заболевания (ЦВЗ) представляют важнейшую медико-социальную проблему современности. Трагедия заключается не только в высокой заболеваемости ЦВЗ, но и в смертности и инвалидности пациентов с этими заболеваниями. Так, в России ежегодно в среднем регистрируют около 400–450 тыс. инсультов (80–85% ишемических), из которых до 200 тыс. заканчиваются смертью, а не менее 80% выживших пациентов, в том числе молодых, остаются инвалидами [11, 21]. Естественно, подобная ситуация отрицательно сказывается и на экономике страны: необходимы огромные финансовые затраты на лечение и реабилитацию пострадавших, снижается качество жизни больных и их семей.
Наряду с острыми нарушениями мозгового кровообращения (ОНМК), важнейшее значение приобретают хронические формы ЦВЗ. Хроническая недостаточность мозгового кровообращения (ХНМК) — одно из наиболее распространенных патологических состояний, особенно среди пациентов пожилого возраста. По современным данным, среди лиц старше 60 лет распространенность ХНМК может достигать 10% [3, 14, 16]. Расходы на лечение больных с сосудистой патологией головного мозга составляют до 20% всех затрат на здравоохранение России [6].
Патологическая морфология хронической недостаточности мозгового кровообращения
Как известно, адекватная работа головного мозга обеспечивается высоким уровнем его кровоснабжения. С возрастом объем мозгового кровотока снижается, что объясняется прогрессирующим атеросклеротическим поражением сосудов головного мозга. Начальные проявления недостаточности мозгового кровоснабжения отмечают, если приток крови к мозгу составляет менее 30–45 мл/100 г/мин. Развернутую стадию наблюдают при снижении кровоснабжения мозга до уровня 20–35 мл/100 г/мин. Критическим признан порог регионарного кровотока в пределах 19 мл/100 г/мин (функциональный порог кровоснабжения мозга), при котором оказываются нарушенными функции соответствующих участков головного мозга. Нервные клетки гибнут при регионарном артериальном мозговом кровотоке, сниженном до 8–10 мл/100 г/мин (инфарктный порог кровоснабжения мозга) [2, 12].
В условиях хронической гипоперфузии мозга, выступающей основным патогенетическим звеном ХНМК, механизмы компенсации истощаются, энергетическое обеспечение мозга становится недостаточным, в результате сначала развиваются функциональные расстройства, а затем — и необратимое морфологическое повреждение. При хронической гипоперфузии мозга выявляют замедление мозгового кровотока, уменьшение содержания кислорода и глюкозы в крови, сдвиг метаболизма глюкозы в сторону анаэробного гликолиза, лактоацидоз, гиперосмолярность, капиллярный стаз, склонность к тромбообразованию, деполяризацию клеточных мембран, а также активацию микроглии, которая начинает вырабатывать нейротоксины, что наряду с другими патофизиологическими процессами приводит к гибели клеток [7, 24, 25].
Поражение мелких пенетрирующих мозговых артерий (церебральная микроангиопатия), от которых зависит кровоснабжение глубинных отделов мозга, у больных ХНМК сопровождается морфологическими изменениями в головном мозге [8, 15, 18, 22].
Основные корригируемые факторы развития хронической ишемии включают АГ и атеросклероз.
Артериальная гипертензия и хроническая недостаточность мозгового кровообращения
Для адекватной ауторегуляции мозгового кровообращения необходимо поддержание определенного АД в магистральных артериях головы. В норме среднее систолическое АД (САД) в них находится в пределах 60–150 мм рт. ст. При длительно существующей АГ эти значения несколько смещаются вверх, поэтому нарушение ауторегуляции не наступает достаточно долго, и уровень мозгового кровообращения остается нормальным. При этом адекватное кровоснабжение мозга поддерживается путем повышения сосудистого сопротивления, что приводит к увеличению нагрузки на сердце. Хроническая неконтролируемая АГ ведет к вторичным изменениям сосудистой стенки — липогиалинозу, наблюдаемому преимущественно в сосудах микроциркуляторного русла. Вследствие этого развивается артериолосклероз, вызывающий изменение физиологической реактивности сосудов. В таких условиях уменьшение АД в результате присоединения сердечной недостаточности со снижением сердечного выброса, избыточной антигипертензивной терапии или физиологических циркадных изменений АД приводит к гипоперфузии в зонах терминального кровообращения [9, 17]. Острые ишемические эпизоды в бассейне глубоких пенетрирующих артерий вызывают лакунарные инфаркты небольшого диаметра в глубинных отделах головного мозга.
При неблагоприятном течении АГ повторные острые эпизоды приводят так называемому лакунарному состоянию — одному из вариантов мультиинфарктной сосудистой деменции [19].
Помимо повторных острых нарушений, предполагается и хроническая ишемия в зонах терминального кровообращения. Маркером последней служит разрежение перивентрикулярного или субкортикального белого вещества (лейкоареозис), которое патоморфологически представляет зону демиелинизации, глиоз и расширение периваскулярных пространств [9, 17]. В некоторых случаях неблагоприятного течения АГ возможно подострое развитие диффузного поражения белого вещества головного мозга с клинической картиной быстро прогрессирующей деменции и других проявлений разобщения, что иногда обозначают в литературе термином «болезнь Бинсвангера» [20].
Атеросклероз и хроническая недостаточность мозгового кровообращения
Как правило, при ХНМК множественное атеросклеротическое поражение сосудов мозга локализовано преимущественно в экстра- и интракраниальных отделах сонных и позвоночных артерий, а также в артериях виллизиева круга и их ветвях, и формирует стенозы. Различают гемодинамически значимые и незначимые стенозы. Снижение перфузионного давления дистальнее атеросклеротического процесса свидетельствует о критическом или гемодинамически значимом сужении сосуда. Гемодинамически значимые стенозы развиваются при сужении просвета сосуда на 70–75%.
Однако мозговой кровоток зависит не только от выраженности стеноза, но и от механизмов, предотвращающих развитие ишемии: состояния коллатерального кровообращения и способности мозговых сосудов к расширению. Указанные гемодинамические резервы мозга позволяют существовать асимптомным стенозам без жалоб и клинических проявлений.
Тем не менее обязательное развитие хронической гипоперфузии мозга при стенозе приводит к ХНМК, выявляемой при МРТ. При этом визуализируются перивентрикулярный лейкоареоз (отражающий ишемию белого вещества мозга), внутренняя и наружная гидроцефалия (обусловленная атрофией мозговой ткани); могут выявляться кисты (как последствие перенесенных инфарктов мозга, в том числе и клинически «немых»).
Считается, что ХНМК есть у 80% пациентов со стенозирующим поражением магистральных артерий головы. Для атеросклеротически измененных сосудов головного мозга характерны не только локальные изменения в виде бляшек, но и гемодинамическая перестройка артерий на участке дистальнее атеросклеротических стенозов и окклюзий. Все это приводит к тому, что асимптомные стенозы становятся клинически значимыми. Большое значение имеет и структура бляшек: так называемые нестабильные бляшки вызывают развитие артерио-артериальных эмболий и ОНМК, чаще по типу преходящих. При кровоизлиянии в такую бляшку ее объем быстро увеличивается с нарастанием степени стеноза и усугублением признаков ХНМК. При наличии подобных бляшек гемодинамически значимым признано перекрытие просвета сосуда до 70%.
При поражении магистральных артерий головы мозговой кровоток становится весьма зависимым от системных гемодинамических процессов. Такие пациенты особенно чувствительны к артериальной гипотензии, возникающей при переходе в вертикальное положение (ортостатической гипотензии), а также к нарушениям сердечного ритма, приводящим к кратковременному снижению сердечного выброса [1, 10].
Клинические проявления хронической недостаточности мозгового кровообращения
Основные клинические проявления ХНМК:
Прогрессирование симптомов постепенно приводит к дезадаптации больных в повседневной жизни.
В течении ХНМК выделяют три стадии [5].
I стадия (компенсация). В клинической картине преобладают субъективные проявления: общая слабость и утомляемость, эмоциональная лабильность, нарушения сна, снижение памяти и внимания, головные боли. Отчетливые неврологические синдромы выделить не удается, но в неврологическом статусе появляются некоторые симптомы: анизорефлексия, дискоординация, симптомы орального автоматизма. Нарушения памяти, праксиса и гнозиса удается выявить, как правило, только при проведении специальных тестов.
При II стадии (субкомпенсации) увеличивается количество субъективных жалоб, а оценка неврологического статуса позволяет выделить конкретные синдромы (пирамидный, дискоординаторный, амиостатический, дисмнестический), один из которых обычно доминирует. Характерно снижение профессиональной и социальной адаптации пациентов.
Особенности III стадии (декомпенсации с развитием сосудистой деменции) включают нарастание выраженности неврологических симптомов, появление отчетливого псевдобульбарного синдрома, иногда — пароксизмальных состояний (в том числе эпилептических припадков). Ярко выраженные когнитивные расстройства приводят к нарушению социальной и бытовой адаптации, полной потере работоспособности. В конечном итоге ХНМК ведет к формированию сосудистой деменции [4].
Ключевым проявлением ХНМК, во многом определяющим тяжесть состояния пациентов, выступают когнитивные нарушения. Зачастую именно они служат ведущим диагностическим критерием ХНМК и чувствительным маркером для оценки прогрессирования заболевания.
Выделяют следующие основные клинические синдромы, характерные для ХНМК:
Особенность цефалгического синдрома состоит в его полиморфности, непостоянстве, в большинстве случаев в отсутствии связи с конкретными сосудистыми и гемодинамическими факторами (исключая головную боль при гипертонических кризах с высоким АД), а также в уменьшении частоты встречаемости по мере прогрессирования болезни.
Второе место по частоте занимает вестибуло-атаксический синдром. Основные жалобы пациентов при этом включают головокружение, неустойчивость при ходьбе и координаторные нарушения. Иногда, особенно на начальных стадиях, больные, жалуясь на головокружение, не отмечают нарушений координации. Недостаточно показательны также результаты отоневрологического исследования.
На более поздних стадиях заболевания субъективные и объективные дискоординаторные нарушения четко взаимосвязаны. Нередко головокружение, неустойчивость при ходьбе частично связаны с возрастными изменениями вестибулярного аппарата, двигательной системы и с ишемической невропатией преддверно-улиткового нерва. Следовательно, для оценки значимости субъективных вестибуло-атаксических нарушений важен их качественный анализ при опросе больного, неврологическом и отоневрологическом обследовании. В большинстве случаев эти расстройства вызваны хронической недостаточностью кровообращения в бассейне кровоснабжения вертебробазилярной артериальной системы, поэтому необходимо не полагаться на субъективные ощущения больных, а искать признаки диффузного поражения отделов мозга, кровоснабжение которых осуществляется из этого сосудистого бассейна.
У некоторых больных с ХНМК II–III стадий атаксические нарушения обусловлены не столько мозжечково-стволовой дисфункцией, сколько поражением лобно-стволовых путей. Возникает феномен лобной атаксии, или апраксии ходьбы, напоминающей гипокинезию больных паркинсонизмом. При КТ выявляют значительную гидроцефалию (наряду с корковой атрофией), то есть возникает состояние, близкое к нормотензивной гидроцефалии. В целом, синдром недостаточности кровообращения в вертебробазилярном бассейне диагностируют при ХНМК чаще, чем недостаточность каротидной системы.
Особенность пирамидного синдрома состоит в его умеренной клинической манифестации (анизорефлексии, мимической асимметрии, минимально выраженных парезах, оживлении рефлексов орального автоматизма, кистевых симптомах). Отчетливая асимметрия рефлексов указывает либо на перенесенный ранее мозговой инсульт, либо на другое заболевание, протекающее под маской ХНМК (например, объемные внутричерепные процессы, последствия травматического повреждения головного мозга). Диффузное и достаточно симметричное оживление глубоких рефлексов, как и патологические пирамидные рефлексы, часто сочетающиеся со значительным оживлением рефлексов орального автоматизма и развитием псевдобульбарного синдрома, особенно в пожилом и старческом возрасте, говорит о многоочаговом сосудистом поражении мозга (при исключении иных возможных причин).
У больных с клиническими проявлениями недостаточности кровообращения в бассейне вертебро-базилярной системы часто наблюдают пароксизмальные состояния.
При ХНМК достаточно характерны психические расстройства, формы которых разнообразны на разных стадиях заболевания. Если на начальных стадиях они имеют вид астенических, астенодепрессивных и тревожно-депрессивных нарушений, то на II и особенно на III стадии к ним присоединяются выраженные дисмнестические и интеллектуальные расстройства, формирующие синдром сосудистой деменции, нередко выходящий в клинической картине на первое место.
Основные подходы к лечению хронической недостаточности мозгового кровообращения.
Цитофлавин и его место в терапии данного заболевания
Говоря о лечении ХНМК, важно помнить о его полиэтиологичности, следовательно, один из основных подходов к терапии предполагает лечение основного заболевания и коррекцию факторов риска, в частности АГ и атеросклероза. Этиотропное лечение включает применение антигипертензивных, антитромбоцитарных, или антикоагулянтных, и гиполипидемических средств, а также сосудистую хирургию.
Вторая, не менее важная стратегия лечения ХНМК — патогенетическая терапия. Именно она позволяет оптимизировать мозговой кровоток и обеспечить нейрометаболическую защиту головного мозга от ишемии и гипоксии. Одними из наиболее перспективных и патогенетически оправданных методов первичной и вторичной нейропротекции выступают терапевтические стратегии, позволяющие уменьшить энергозатраты и выраженность постгипоксических церебральных нарушений [13]. В неврологической практике с успехом используют препараты на основе янтарной кислоты, представленные отечественным комплексным препаратом Цитофлавин.
В состав таблетированной формы Цитофлавина, помимо янтарной кислоты, входят рибоксин (инозин), никотинамид и рибофлавин.
Янтарная кислота как ключевой компонент препарата выступает в роли важнейшего эндогенного внутриклеточного метаболита, выполняющего каталитическую функцию в цикле Кребса, ускоряя кругооборот цикла и стимулируя синтез АТФ — универсального источника энергии. Антигипоксическое действие янтарной кислоты реализуется вследствие увеличения концентрации гамма-аминомасляной кислоты в мозговой ткани.
Рибофлавин — энергокорректор — флавиновый кофермент, активирующий окислительно-восстановительные реакции цикла Кребса.
Никотинамид — антигипоксант + антиоксидант — влияет на окислительно-восстановительные процессы, замедляет развитие энцефалопатии и ее проявлений.
Инозин (рибоксин) — энергокорректор — производное пурина, предшественник АТФ (метаболит). Обладает способностью активировать некоторые ферменты цикла Кребса, стимулируя синтез ключевых веществ. Защищает клетки от повреждающих факторов.
В состав раствора для инъекций, помимо указанных выше компонентов, входит вспомогательное вещество N-метилглюкамин, ускоряющее доставку действующих агентов Цитофлавина в цитоплазму, а затем и на внутреннюю мембрану митохондрий. Данные особенности позволяют использовать препарат в ургентных ситуациях, когда время начала терапии сводится к минутам.
Все компоненты Цитофлавина представлены естественными метаболитами организма и стимулируют тканевое дыхание. Метаболическая энергокоррекция, антигипоксическая и антиоксидантная активность препарата обусловлены взаимодополняющим действием янтарной кислоты, инозина, никотинамида и рибофлавина. В отличие от других антигипоксантов Цитофлавин работает на всех этапах клеточного дыхания (рис. 1).
Рис. 1. Точки приложения Цитофлавина в каскаде клеточного дыхания.
Примечание: ПВК — пировиноградная кислота, МК — молочная кислота, АцХ — ацетилхолин; КоА — коэнзим А, ЭМГПС — этилметилгидроксипиридина сукцинат
Таким образом, Цитофлавин обладает суммой основных (антигипоксического, антиоксидантного, энергокоррекционного) и плейотропных эффектов: антиишемическим, нейропротективным, метаболическим, репаративным, эрготропным, антиастеническим, восстановительным. При этом препарат оказывает универсальное действие при различных нарушениях функций головного мозга, защищает его благодаря антигипоксическому действию и инициирует естественные процессы самовосстановления.
Особенности фармакологических эффектов Цитофлавина определяют и область его применения в клинической практике. Показаниями к назначению Цитофлавина у взрослых являются:
Многочисленные исследования разного уровня продемонстрировали эффективность применения Цитофлавина у пациентов с различными формами ХНМК.
Так, по данным крупного исследования эффективности препарата у 600 пациентов с астеноневротическим синдромом на фоне хронической церебральной недостаточности, применение Цитофлавина по 2 таблетки 2 раза в сутки в течение 25 дней способствовало положительной динамике неврологического статуса больных хронической ишемией головного мозга. Чаще всего после курса лечения отмечали уменьшение выраженности астенического, цефалгического, вестибуло-мозжечкового и кохлеовестибулярного синдромов, а также расстройств эмоционально-волевой сферы (рис. 2).
Рис. 2. Клинические проявления (по формализованной шкале) у больных хронической ишемией мозга на 30-е сутки после приема Цитофлавина (выраженность симптома: 0 баллов — нет, 1 балл — незначительно, 2 балла — умеренно, 3 балла — выраженный симптом)
Кроме того, по результатам многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования эффективности Цитофлавина у пациентов с хронической ишемией головного мозга, терапия повышала показатели шкалы двигательной активности Тиннетти, что свидетельствовало о статистически значимом улучшении функции поддержания равновесия и ходьбы (рис. 3).
Рис. 3. Двигательная активность (по шкале Тиннети) у пациентов с хронической ишемией мозга на 30-е сутки после приема Цитофлавина
Таким образом, Цитофлавин увеличивает объем непосредственного запоминания предложенного словесного или цифрового материала, улучшает внимание и существенно повышает объем запоминаемой информации, а также улучшает когнитивную сферу (процессы запоминания, мышления, внимания) у пациентов с хронической ишемией мозга. Помимо этого, эффект Цитофлавина сохраняется и на 30-е сутки после прекращения курса лечения.
Опубликованы доказательства эффективности применения Цитофлавина и при отдельных формах ХНМК. В частности, у пациентов с гипертонической энцефалопатией препарат статистически значимо уменьшал частоту жалоб, в том числе специфических «венозных», способствовал снижению выраженности цефалгического синдрома, а также проявлений астенических и вегетативных расстройств. Кроме того, прием Цитофлавина обеспечивал улучшение показателей церебральной гемодинамики таких пациентов и повышение качества их жизни в целом.
Продемонстрирована высокая степень безопасности препарата: не зафиксировано его непереносимости, побочных явлений, как и нежелательных взаимодействий с препаратами базисной терапии.
Отдельную группу составляют пациенты с ОНМК. Согласно международным рекомендациям, нейропротективную терапию при инсульте необходимо начать как можно раньше, в том числе на догоспитальном этапе, и продолжать до полного подтверждения диагноза. В ходе исследования, посвященного оценке влияния терапии Цитофлавином на формирование очага ишемического повреждения в остром периоде полушарного инсульта, выявлена тенденция к более полному сохранению вещества мозга в остром периоде инсульта на фоне использования препарата. Прием Цитофлавина способствовал уменьшению неврологического дефицита и увеличению способности пациентов к самообслуживанию, что связано с меньшим конечным объемом поражения мозга.
Помимо доказанной эффективности Цитофлавина, не менее важен его профиль безопасности. В ходе многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования побочные эффекты Цитофлавина отмечены лишь у 1,25% пациентов. Они связаны лишь с нарушением засыпания при позднем (позже 20–22 часов) приеме препарата (рис. 4). Его отмена при этом не требовалась.
Рис. 4. Безопасность применения Цитофлавина
Следует отметить также удобную схему приема Цитофлавина, а благодаря двум формам выпуска (в растворе для инъекций и в таблетках для приема внутрь) есть возможность ступенчатой терапии (табл.).
Таблица. Схема применения Цитофлавина
| Показания | Период заболевания | Схема приема | Длительность курса |
| Острые нарушения мозгового кровообращения | Острая фаза | 10 мл 2 раза в сутки в/в капельно на 200 мл 5% р-ра глюкозы или 0,9% р-ра натрия хлорида | 10 дней |
| Ранний восстановительный период | 10 мл 1 раз в сутки в/в капельно на 200 мл 5% р-ра глюкозы или 0,9% р-ра натрия хлорида | 10 дней | |
| Хроническая ишемия мозга | Декомпенсация | 10 мл 2 раза в сутки в/в капельно на 200 мл 5% р-ра глюкозы или 0,9% р-ра натрия хлорида | 10 дней |
| Субкомпенсация | 10 мл 1 раз в сутки в/в капельно на 200 мл 5% р-ра глюкозы или 0,9% р-ра натрия хлорида | 10 дней | |
| Поддерживающая терапия | 2 таблетки 2 раза в день | 25 дней | |
| Гипоксическая энцефалопатия | Декомпенсация | 10 мл 2 раза в сутки в/в капельно на 200 мл 5% р-ра глюкозы или 0,9% р-ра натрия хлорида | 5 дней |
| Субкомпенсация | 10 мл 1 раз в сутки в/в капельно на 200 мл 5% р-ра глюкозы или 0,9% р-ра натрия хлорида | 5 дней | |
| Поддерживающая терапия | 2 таблетки 2 раза в день | 25 дней | |
| Астенический синдром | – | 2 таблетки 2 раза в день | 25 дней |
| Последствия легкой черепно-мозговой травмы | – | 2 таблетки 2 раза в день | 25 дней |
Нормативно-правовая база назначений
Согласно распоряжению Правительства РФ от 26.12.2015 г. № 2724-р, Цитофлавин вошел в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2016 г., а также в перечень лекарственных препаратов для медицинского применения, назначаемых по решению врачебных комиссий медицинских организаций.
Кроме того, использование Цитофлавина у пациентов с ОНМК на догоспитальном этапе отражено в приказе МЗ РФ от 22.01.2016 г. № 36н «Об утверждении требований к комплектации лекарственными препаратами и медицинскими изделиями укладок и наборов для оказания скорой медицинской помощи».
Заключение
«Когда мозг здоров и находится в спокойном состоянии, то человек здраво мыслит». Эти слова принадлежат Гиппократу. Действительно, лишь адекватно функционирующий мозг способен обеспечить не только физическое, но и социальное здоровье.
Тем не менее именно цереброваскулярные заболевания, в частности хронические нарушения мозгового кровообращения, представляют одну из наиболее актуальных проблем современной медицины.
Патогенетическая терапия хронических нарушений мозгового кровообращения выступает ключевым звеном в общей терапевтической стратегии данной группы заболеваний. Одно из перспективных направлений предполагает применение препаратов на основе янтарной кислоты у пациентов с хронической ишемией головного мозга. Отечественным представителем группы, продемонстрировавшим высокую эффективность во множестве исследований, является препарат Цитофлавин.
Богатая доказательная база позволяет с успехом применять Цитофлавин не только в неврологической, но и в терапевтической практике.
Литература
Библиографическая ссылка:
Вёрткин А. Л., Абдуллаева А. У. Самый редкий вид дружбы — дружба с собственной головой… Современные подходы к терапии хронического нарушения мозгового кровообращения // Амбулаторный прием. 2017. Т. 3. № 1 (7). С. 35–41.
Вёрткин Аркадий Львович — д. м. н., профессор, заведующий кафедрой терапии, клинической фармакологии и скорой медицинской помощи ФБОУ ВО «МГМСУ им. А. И. Евдокимова» Минздрава России.
Абдуллаева Асият Умаровна — ассистент кафедры терапии, клинической фармакологии и скорой медицинской помощи ФГБОУ ВО «МГМСУ им. А. И. Евдокимова» Минздрава России.