масса атома углерода чему равна
Молярная масса углерода
Молярная масса углерода
Любое химическое соединение кроме молярной массы характеризуется относительной молекулярной массой. Относительная молекулярная масса Mr – это молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода-12 ( 12 С). Это безразмерная величина.
Относительная атомная масса Ar – это молярная масса атома вещества, отнесенная к 1/12 молярной массы атома углерода-12 ( 12 С).
Относительная атомная масса углерода равна 12,0116 а.е.м. Его относительная молекулярная масса будет равна 12,0116, а молярная масса:
M(С) = Mr (С) × 1 моль = 12,0116 г/моль.
В обычных условиях углерод (строение атома показано на рис. 1) может существовать в виде нескольких простых веществ – аллотропных модификаций. Таковыми являются алмаз, кристаллизующийся в кубической и гексагональной (лонсдейлит) системе, и графит, принадлежащий к гексагональной системе. Все они имеют молярную массу равную 12,0116 г/моль. Кроме этого известны и другие формы углерода, например, древесный уголь, кокс, сажа, карбин, поликумулен, графен, фуллерен, нанотрубки, нановолокна, астрален и т.д.
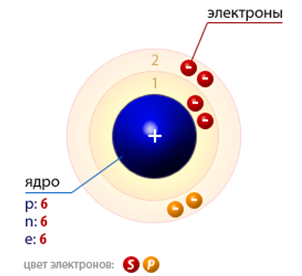
Рис. 1. Строение атома углерода.
Углерод не может существовать в виде газа, только в форме твердого вещества, поэтому для нахождения значения его молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Примеры решения задач
| Задание | Термохимическое уравнение неполного горения углерода выглядит следующим образом: |
2C + O2 = 2CO + 220 кДж.
Рассчитайте количество теплоты, которая выделится при сгорании углерода массой 3 г.
Данное термохимическое уравнение реакции показывает, что при сгорании 24 г углерода выделяется 220 кДж теплоты. Примем за «х» количество теплоты, которое выделится при сгорании 3 г углерода и составим пропорцию:
x = 3 × 220 / 24 = 27,5 кДж.
| Задание | При сгорании угля массой 187,5 г образовался оксид углерода (IV) объемом 336 л (нормальные условия). Вычислите массовую долю углерода в угле. |
| Решение | Запишем уравнение реакции сгорания угля: |
Найдем количество вещества образовавшегося оксида углерода (IV):
n(CO2) = 336 / 22,4 = 15 моль.
Согласно уравнению реакции n(CO2) :n(C) = 1:1, т.е. n(CO2) =n(C) = 15 моль. Рассчитаем массу углерода (молярная масса равна 12 г/моль):
Углерод, свойства атома, химические и физические свойства
Углерод, свойства атома, химические и физические свойства.
12,0096-12,0116* 1s 2 2s 2 2p 2
Углерод — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 6. Расположен в 14-й группе (по старой классификации — главной подгруппе четвертой группы), втором периоде периодической системы.
Атом и молекула углерода. Формула углерода. Строение атома углерода:
Углерод – неметалл.
Углерод обладает способностью образовывать полимерные цепочки, что порождает огромный класс соединений на основе углерода, называемых органическими, которых значительно больше, чем неорганических.
Углерод обозначается символом С.
Молекула углерода одноатомна.
Химическая формула углерода С.
Строение атома углерода. Атом углерода состоит из положительно заряженного ядра (+6), вокруг которого по двум оболочкам движется 6 электронов. При этом 2 электрона находятся на внутреннем уровне, а 4 электрона – на внешнем. Поскольку углерод расположен во втором периоде, оболочек всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлены s- и р-орбиталями. На внешнем энергетическом уровне атома углерода на 2s-орбитали находятся два спаренных электрона, на 2p-орбитали находятся два неспаренных электрона. В свою очередь ядро атома углерода состоит из 6 протонов и 6 нейтронов. Углерод относится к элементам p-семейства.
Радиус атома углерода (вычисленный) составляет 67 пм.
Атомная масса атома углерода составляет 12,0096-12,0116 а. е. м.
Содержание углерода в земной коре составляет 0,18 %, в морской воде и океане – 0,0028 %.

















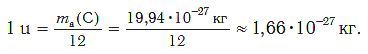
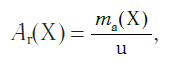
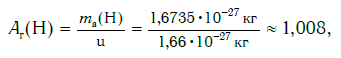
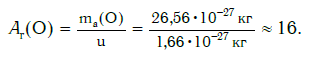
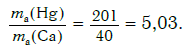
 .
. ,
, .
.