маркеры преэклампсии что это
Преэклампсия
патология, которая встречается только во время беременности.
Она развивается достаточно часто – у 5-8 из 100 беременных.
Ее симптомы возникают после 20 недель, хотя предшествующие им патологические изменения начинаются намного раньше. Это опасное осложнение, оно может приводить к серьезным расстройствам у будущей мамы и ребенка, представляет угрозу не только для здоровья, но и для жизни. Всё, что может сделать врач, когда симптомы уже появились – назначить лечение для облегчения симптомов.
Причины преэклампсии активно изучаются, а единственный способ справиться с ней – роды.
ЛЮБАЯ ЖЕНЩИНА. ЛЮБОЙ ВОЗРАСТ. ЛЮБАЯ БЕРЕМЕННОСТЬ.
В настоящее время существуют скрининговые исследования для раннего выявления риска преэклампсии, эффективные меры профилактики. Вы можете пройти полное обследование в нашей специализированной лаборатории ЦИР.
1 ТРИМЕСТР БЕРЕМЕННОСТИ –
ВРЕМЯ СДЕЛАТЬ СКРИНИНГ ПРЕЭКЛАМПСИИ.
Своевременное выявление и лечение помогает до 90% беременных.
Пройдите скрининг сейчас:
Почему развивается преэклампсия у беременных?
Плацента работает как эндокринный орган: она выделяет в кровь некоторые биологически активные вещества, которые нужны для нормального протекания беременности, развития плода. Если этих веществ вырабатывается слишком много, они поступают в кровоток будущей матери и вызывают в ее организме нарушения.
Например, одно из таких веществ – растворимая fms-подобная тирозинкиназа (sFlt-1). Поступая в материнский кровоток, она повышает свертываемость крови, способствует сужению сосудов, повреждает их стенку и усиливает проницаемость. В ходе научных исследований доказано, что повышенный уровень sFlt-1 играет важную роль в развитии преэклампсии.
Существуют и другие теории. Считается, что развитию преэклампсии способствуют: системное воспаление, нарушения работы иммунитета, неспособность сердечно-сосудистой системы женщины адаптироваться к беременности, гестационный диабет, нехватка некоторых питательных веществ, витаминов, минералов.
Чаще всего преэклампсия развивается во время первой беременности
у женщин младше 20 и старше 40 лет.
Известны некоторые факторы риска:
Патологические изменения начинаются еще на ранних сроках беременности, но симптомы и осложнения развиваются к её концу (после 20 недели). Когда возникают выраженные проявления, сделать уже практически ничего нельзя. Но в настоящее время существуют исследования, которые помогают выявить риск преэклампсии на ранних сроках и своевременно принять некоторые меры. Поэтому так важно проходить скрининг.
Преэклампсия и эклампсия
По данным Минздрава России, преэклампсия и другие осложнения беременности, связанные с повышенным артериальным давлением, занимают четвертое место среди причин материнской смертности в течение последних десяти лет. Преэклампсия – одна из самых распространенных причин преждевременных родов, задержки развития плода, антенатальной гибели плода. Она часто становится показанием к кесареву сечению. Возможные осложнения преэклампсии: отслойка плаценты и мертворождение, инсульт, сердечная недостаточность, отек легких, обратимая слепота, кровотечение в печени, HELLP-синдром, острая почечная недостаточность. Когда уже возникли тяжелые симптомы, единственный способ спасти маму и ребенка – как можно раньше провести оперативное родоразрешение. Но проявления могут сохраняться еще в течение 1–6 недель после того, как ребенок появился на свет.
Даже после родов преэклампсия приводит к серьезным последствиям для здоровья мамы и ребенка. У женщины повышается риск ожирения, артериальной гипертонии, сахарного диабета, ишемической болезни сердца, инсульта. У ребенка повышается риск гормональных, сердечно-сосудистых расстройств, заболеваний, связанных с нарушением обмена веществ.
Опасное осложнение преэклампсии – эклампсия. Это состояние проявляется в виде судорожных припадков, причем, оно может возникать, даже если симптомы преэклампсии выражены слабо или совсем отсутствуют.
Сложно сказать, у кого именно разовьется преэклампсия. Если женщина совершенно здоровая, и у нее нет факторов риска, это еще ни о чем не говорит. Преэклампсия может развиваться у любой женщины во время любой беременности.
Что такое преэклампсия (гестоз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Дубового А. А., акушера со стажем в 13 лет.
Определение болезни. Причины заболевания
Преэклампсия — это осложнение беременности, при котором из-за увеличения проницаемости стенки сосудов развиваются нарушения в виде артериальной гипертензии, сочетающейся с потерей белка с мочой (протеинурией), отеками и полиорганной недостаточностью. [1]
Сроки развития преэклампсии
Причины преэклампсии
По сути, причина преэклампсии — беременность, именно при ней возникают патологические события, в конечном счете приводящие к клинике преэклампсии. У небеременных преэклампсии не бывает.
В научной литературе описывается более 40 теорий происхождения и патогенеза преэклампсии, а это указывает на отсутствие единых взглядов на причины ее возникновения.
Факторы риска
Установлено, что преэклампсии чаще подвержены молодые и нерожавшие женщины (от 3 до 10%). [2] У беременных с планируемыми вторыми родами риск ее возникновения составляет 1,4-4%. [3]
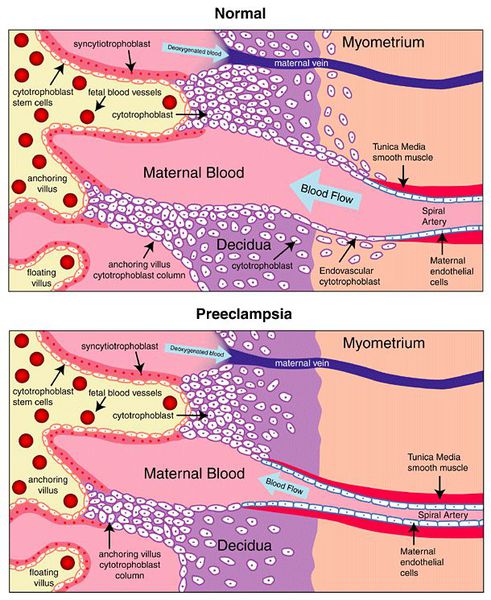
Пусковым моментом в развитии преэклампсии в современном акушерстве считается нарушение плацентации. Если беременность протекает нормально, с 7 по 16 неделю эндотелий (внутренняя оболочка сосуда), внутренний эластичный слой и мышечные пластинки участка спиральных артерий, вытесняется трофобластом и фибриносодержащим аморфным матриксом (составляющие предшественника плаценты — хориона). Из-за этого понижается давление в сосудистом русле и создается дополнительный приток крови для обеспечения потребностей плода и плаценты. Преэклампсия связана с отсутствием или неполным вторжением трофобласта в область спиральных артерий, что приводит к сохранению участков сосудистой стенки, имеющей нормальное строение. В дальнейшем воздействие на эти сосуды веществ, вызывающих вазоспазм, ведет к сужению их просвета до 40% от нормы и последующему развитию плацентарной ишемии. При нормальном течении беременности до 96% из 100-150 спиральных артерий матки претерпевают физиологические изменения, при преэклампсии же — всего 10%. Исследования подтверждают, что наружный диаметр спиральных артерий при патологической плацентации вдвое меньше, чем должно быть в норме. [4] [5]
Симптомы преэклампсии
Раньше в отечественном акушерстве то, что сейчас называется термином «преэклампсия», называлось «поздний гестоз», а непосредственно под преэклампсией при беременности понимали тяжелую степень позднего гестоза. Сегодня в большинстве регионов России перешли на классификацию, принятую ВОЗ. Ранее говорили о так называемом ОПГ-гестозе (отеки, протеинурия и гипертензия).
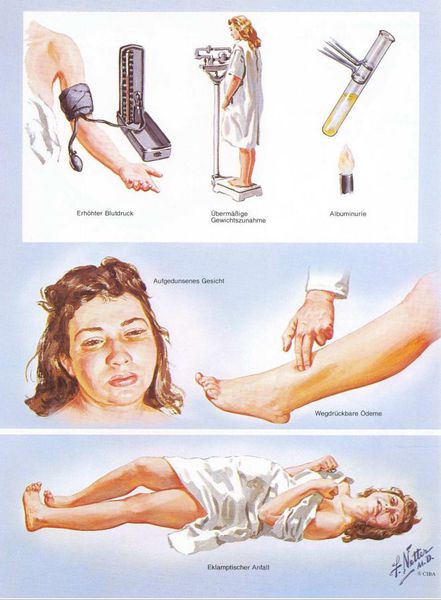
1. Артериальная гипертензия
Преэклампсия характеризуется систолическим АД>140 мм рт. ст. и/или диастолическим АД>90 мм рт. ст., измеряется дважды с интервалом 6 часов. По меньшей мере два повышенных значения АД являются основанием для диагностики АГ во время беременности. Если есть сомнения, рекомендуется провести суточное мониторирование АД (СМАД).
2. Протеинурия
Чтобы диагностировать протеинурию, необходимо выявить количественное определение белка в суточной порции (в норме при беременности — 0,3 г/л). Клинически значимая протеинурия во время беременности определена как наличие белка в моче ≥ 0,3 г/л в суточной пробе (24 часа) либо в двух пробах, взятых с интервалом в 6 часов; при использовании тест-полоски (белок в моче) — показатель ≥ «1+».
Умеренная протеинурия — это уровень белка > 0,3 г/24 часа или > 0,3 г/л, определяемый в двух порциях мочи, взятой с интервалом в 6 часов, или значение «1+» по тест-полоске.
Выраженная протеинурия — это уровень белка > 5 г/24 часа или > 3 г/л в двух порциях мочи, взятой с интервалом в 6 часов, или значение «3+» по тест-полоске.
Чтобы оценить истинный уровень протеинурии, нужно исключить наличие инфекции мочевыделительной системы, а патологическая протеинурия у беременных является первым признаком полиорганных поражений. [1]
3. Отечный синдром
Триада признаков преэклампсии, описанная Вильгельмом Цангемейстером в 1912 г. (ОПГ-гестоз), сегодня встречается лишь в 25-39%. Наличие отеков в современном акушерстве не считается диагностическим критерием преэклампсии, но важно, когда нужно оценить степень ее тяжести. Когда беременность протекает нормально, отеки встречаются в 50-80% случаев, амбулаторное ведение безопасно для лёгкого отечного симптома. Однако генерализованные, рецидивирующие отеки зачастую являются признаком сочетанной преэклампсии (нередко на фоне патологии почек). [6]
Американский врач-хирург и художник-иллюстратор Фрэнк Генри Неттер, которого справедливо прозвали «Микеланджело медицины», очень наглядно изобразил основные проявления преэклампсии. [7]
Патогенез преэклампсии
В ответ на ишемию при нарушении имплантации (см. рисунок) начинают активно вырабатываться плацентарные, в том числе антиангиогенные факторы и медиаторы воспаления, повреждающие клетки эндотелия. [8] Когда компенсаторные механизмы кровообращения на исходе, плацента с помощью прессорных агентов активно «подстраивает» под себя артериальное давление беременной, при этом временно усиливая кровообращение. В итоге этого конфликта возникает дисфункция эндотелия. [9]
При развитии плацентарной ишемии активируется большое количество механизмов, ведущих к повреждению эндотелиальных клеток во всем организме, если процесс генерализуется. В результате системной эндотелиальной дисфункции нарушаются функции жизненно важных органов и систем, и в итоге мы имеем клинические проявления преэклампсии.
Нарушение плацентарной перфузии из-за патологии плаценты и спазма сосудов повышает риск гибели плода, задержки внутриутробного развития, рождения детей малых для срока и перинатальной смертности. [10] Кроме того, состояние матери нередко становится причиной прерывания беременности на раннем этапе — именно поэтому дети, родившиеся от матерей с преэклампсией, имеют более высокий показатель заболеваемости респираторным дистресс-синдромом. Отслойка плаценты очень распространена среди больных преэклампсией и связана с высокой перинатальной смертностью.
Классификация и стадии развития преэклампсии
В Международной классификации болезней (МКБ-10) преэкслампсия кодируется как О14. Выделяют умеренную и тяжёлую форму заболевания.
Эклампсия – состояние, при котором в клинических проявлениях преэклампсии преобладают поражения головного мозга, сопровождаемые судорожным синдромом, который не может быть объяснен другими причинами, и следующим после него периодом разрешения. Эклампсия может развиться на фоне преэклампсии любой степени тяжести, а не является проявлением максимальной тяжести преэклампсии.
Осложнения преэклампсии
Основные осложнения при преэклампсии у беременных:
Диагностика преэклампсии
Диагностика преэклампсии заключается прежде всего в установлении наличия указанных выше симптомов. В ряде случаев представляет сложность дифференциальная диагностика преэклампсии и существовавшая до беременности артериальная гипертензия.
Дифференциальная диагностика гипертензивных осложнений беременности
| Клинические признаки | Хроническая гипертензия | Преэклампсия |
|---|---|---|
| Возраст | часто возрастные (более 30 лет) | часто молодые ( [1] |
2. Антигипертензивная терапия
Цель лечения — поддерживать АД в пределах, которые сохраняют на нормальном уровне показатели маточно-плодового кровотока и снижают риск развития эклампсии.
Антигипертензивную терапию следует проводить, постоянно контролируя состояние плода, потому что снижение плацентарного кровотока провоцирует у него прогрессирование функциональных нарушений. Критерием начала антигипертензивной терапии является АД ≥ 140/90 мм рт. ст.
Основные лекарственные средства, используемые для лечения АГ в период беременности:
3. Профилактика и лечение судорог
Для профилактики и лечения судорог основным препаратом является сульфат магния (MgSO4). Показанием для противосудорожной профилактики является тяжелая преэклампсия, если есть риск развития эклампсии. При умеренной преэклампсии — в отдельных случаях решает консилиум, потому что при этом повышается риск кесарева сечения и есть ряд побочных эффектов. Механизм действия магния объясняется нарушением тока ионов кальция в гладкомышечную клетку.
Кроме того, необходимо контролировать водный баланс, уделять внимание лечению олигурии и отека легких при их возникновении, нормализации функции ЦНС, реологических свойств крови, улучшение плодового кровотока.
Прогноз. Профилактика
Сегодня до 64% смертей от преэклампсии предотвратимы.
Основные факторы качественной и своевременной помощи:
К сожалению, сегодня нет достаточно чувствительных и специфичных тестов, которые бы обеспечивали раннюю диагностику/выявление риска развития преэклампсии.
Факторы риска развития преэклампсии: [2]
1. антифосфолипидный синдром;
2. заболевания почек;
3. преэклампсия в анамнезе;
4. предстоящие первые роды;
5. хроническая гипертензия;
7. жительницы высокогорных районов;
8. многоплодная беременность;
9. сердечно-сосудистые заболевания в семье (инсульты/инфаркты у близких родственников);
10. системные заболевания;
12. преэклампсия в анамнезе у матери пациентки;
13. возраст 40 лет и старше;
14. прибавка массы тела при беременности свыше 16 кг.
Установлено, что для преэклампсии характерен недостаточный ангиогенез — процесс образования сосудов. [11] В нем участвуют около 20 стимулирующих и 30 ингибирующих ангиогенез факторов, их список постоянно пополняется. Наиболее изучен и представляют особый интерес с точки зрения исследования патогенеза преэклампсии два проангиогенных фактора: сосудисто-эндотелиальный фактор роста (VEGF) и плацентарный фактор роста (PlGF), антиангиогенный фактор — Fms-подобная тирозинкиназа (Flt-1) и ее растворимая форма (sFlt-1).
Повышение содержания этого sFlt-1 с одновременным снижением VEGF и PlGF начинается за 5-6 недель до клинических проявлений преэклампсии. [12] Данный факт позволяет прогнозировать развитие преэклампсии у женщин из группы риска в первом триместре беременности. Однако другими исследователями отмечено, что несмотря на высокую чувствительность теста (96%), изолированное определение sFlt-1 не может быть использовано при диагностике преэклампсии из-за низкой специфичности. Таким образом, обнаружение изменений в соотношении уровня PlGF и sFlt-1 в течение беременности может сыграть важную вспомогательную роль для подтверждения диагноза преэклампсии.
Сегодня существуют коммерческие наборы, которые позволяют проводить иммуноферментное исследование, чтобы определить вероятность развития преэклампсии, на основании определения содержания PlGF (DELFIA Xpress PlGF kit, PerkinElmer; США), предложены скрининговые тесты для прогнозирования и ранней диагностики преэклампсии, основанные на определении соотношения sFlt-1 и PlGF (Elecsys sFlt-1/PlGF, Roche, Швейцария).
Из-за нарушения инвазии трофобласта увеличивается сосудистое сопротивление в маточной артерии и снижается перфузия плаценты. Повышение пульсационного индекса и систолодиастолического отношения в маточной артерии в 11-13 недель беременности является лучшим предиктором преэклампсии, и его настоятельно рекомендуется использовать в клинической практике у беременных из группы риска.
Профилактика преэклампсии
Из-за того, что исчерпывающая информация об этиологии и патофизиологии преэклампсии отсутствует, разработка эффективных профилактических мер представляет определенные трудности.
Сегодня доказан прием только 2 групп препаратов для профилактики преэклампсии: [1] [2]
• Аспирин в низких дозах (75 мг в день), начиная с 12 недель до родоразрешения. При этом необходимо брать письменное информированное согласие пациентки, поскольку согласно инструкции по применению, прием аспирина противопоказан в первом триместре.
• Беременным с низким потреблением кальция (
Диагностика и оценка риска развития преэклампсии (sFlt-1/PlGF)
Расчет соотношения концентраций растворимой фмс-подобной тирозинкиназы-1 (sFlt-1) и плацентарного фактора роста (PlGF), которое используется для оценки риска развития и степени тяжести преэклампсии.
Растворимая фмс-подобная тирозинкиназа-1 / Плацентарный фактор роста.
Solublefms-like tyrosinekinase-1 / Placental Growth Factor.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Диагноз «преэклампсия» чаще всего ставится на основании достаточно неспецифических симптомов и признаков, главным образом – гипертензии и протеинурии. Следует, однако, отметить, что анализы на белок в моче могут быть неточными, и что осложнения преэклампсии часто возникают до того, как протеинурия становится выраженной. Кроме того, клиническая картина преэклампсии может значительно варьировать от мягкой поздней формы до тяжелой и быстро прогрессирующей ранней преэклампсии, требующей немедленного родоразрешения. Эти особенности свидетельствуют о том, что «классическое» определение преэклампсии (гипертензия более 140/90 мм рт. ст. и протеинурия 0,3 г в суточной моче) не достаточно для того, чтобы полностью охватить все компоненты этого синдрома. Учитывая это, последние рекомендации допускают диагностику преэклампсии на основании гипертензии и признаков нарушения функции органов беременной женщины, а не протеинурии. Также большое внимание уделяется новым методам диагностики и оценки риска преэклапсии. Одним из таких методов является соотношение sFlt-1/PlGF.
sFlt-1/PlGF – это соотношение концентраций в крови двух белков: растворимой fms-подобной тирозинкиназы-1 (sFlt) и плацентарного фактора роста (PlGF). Оба белка вырабатываются плацентой. PlGF обладает ангиогенными свойствами. Считается, что он необходим для нормального развития сосудистой системы плаценты. В норме концентрация PlGF постепенно возрастает к 30 неделе беременности. sFlt обладает антиангиогенными свойствами. Считается, что он связывает и нейтрализует PlGF и другие ангиогенные факторы. При нормально протекающей беременности уровень sFlt-1 остается стабильно низким вплоть до 33-36 недели беременности, после чего он незначительно возрастает вплоть до родов. При преэклампсии наблюдают обратные изменения: снижение концентрации PlGF и увеличение концентрации sFlt-1. Вероятно, изменение соотношения sFlt-1/PlGF является одной из причин развития преэклампсии. С практической точки зрения, это соотношение исследуют для оценки риска развития и степени тяжести этого заболевания.
Применение соотношения sFlt-1/PlGF у женщин с симптомами и признаками, подозрительными на преэклампсию:
В эту группу пациентов относятся женщины, у которых преэклампсия подозревается на основании таких признаков, как нарушение зрения, снижение количества тромбоцитов и других, но отсутствуют классические критерии заболевания «гипертензии плюс протеинурия».
Такие женщины должны быть госпитализированы и находиться под очень тщательным наблюдением. Очень высокое значение соотношения sFlt-1/PlGF>655 (при ранней форме) или >201(при поздней форме) ассоциировано с необходимостью родоразрешить в течение следующих 48 часов.
Повторное исследование соотношенияsFlt-1/PlGF через 2-4 дня может помочь оценить степень риска развития преэклампсии. У женщин с относительно стабильным результатом при повторном анализе вероятность быстрого ухудшения состояния пациентки маленькая. В этом случае, тест может быть повторен еще раз через 2 недели. С другой стороны, если при повторном анализе соотношениеsFlt-1/PlGF нарастает, это указывает на прогрессирование состояния.
Применение соотношения sFlt-1/PlGF у бессимптомных женщин из группы высокого риска развития преэклампсии:
В эту группу относятся женщины с факторами риска преэклампсии (ожирение, осложненный по преэклампсии семейный и личный анамнез, антифисфолипидный синдром, инсулинзависимый сахарный диабет, многоплодная беременность, отсутствие родов в анамнезе, артериальная гипертензия до беременности, болезнь почек до беременности) и женщины с нарушениями маточно-плацентарного кровотока по данным допплеровского исследования.
Исследование проводят на 24-26 неделе беременности. У пациенток с нормальным результатом соотношения sFlt-1/PlGF диагноз «преэклампсия» исключен, по крайней мере в течение 1 недели, но не на протяжении всей беременности. В этой группе может быть показано повторное исследование. Напротив, у пациенток с высоким значением sFlt-1/PlGF подозревается преэклампсия, и они должны быть направлены под более тщательное наблюдение.
Применение соотношения sFlt-1/PlGF у женщин подтвержденным диагнозом преэклампсии:
У женщин с подтвержденным диагнозом преэклампсии (гипертензии и протеинурия) соотношение sFlt-1/PlGF не добавляет никакой новой диагностической информации, но может быть использовано для оценки прогноза: более высокое значение sFlt-1/PlGF говорят о тяжелой степени заболевания.
Необходимо помнить следующие ограничения применения соотношения sFlt-1/PlGF:
Результаты анализа интерпретируют с учетом всех значимых анамнестических, клинических, других лабораторных и инструментальных данных.
Для чего используется анализ?
Когда назначается анализ?
Что означают результаты?
Референсные значения: менее 38.
Соотношение sFlt-1/PlGF:
Риск преэклампсии
Что может влиять на результат?
Кто назначает исследование?
Акушер-гинеколог, врач общей практики.
Литература
Подписка на новости
Оставьте ваш E-mail и получайте новости, а также эксклюзивные предложения от лаборатории KDLmed
Прогностические биохимические маркеры преэклампсии
Преэклампсия (ПЭ) – мультисистемное патологическое состояние, возникающее во второй половине беременности (после 20-й недели) и характеризующееся артериальной гипертензией de novo (≥140/90 мм рт. ст.) в сочетании с протеинурией (≥0,3 г/л в суточной пробе) и проявлениями полиорганной недостаточности [1, 2]. Ежегодно в мире регистрируется свыше 8 млн случаев ПЭ, от чего умирают 60 тыс. женщин [3]. Фактически в структуре акушерских причин материнской смертности ПЭ занимает второе место после тромбоэмболических осложнений.
Частота ПЭ достигает 3-8% всех беременностей с существенными различиями в зависимости от страны проживания [4]. Так, в развивающихся странах с ограниченным доступом к высококачественной медицинской помощи показатели смертности достигают 15% среди пациенток с ПЭ, тогда как в высокоразвитых странах этот показатель составляет всего 0-1,8% [5]. В настоящее время отмечается рост заболеваемости ПЭ даже в странах с высоким уровнем дохода [6]. Причиной тому является увеличение частоты таких заболеваний, как ожирение, диабет, хроническая артериальная гипертензия. Преэклампсия является мультифакторным, тяжелейшим осложнением беременности. Среди факторов риска ПЭ выделяют непосредственно факторы, связанные с беременностью, а также материнские и отцовские (табл. 1) 10.
ПЭ имеет широкий спектр клинических проявлений, которые могут оказывать влияние на центральную нервную, сердечно-сосудистую и мочевыделительную системы, желудочно-кишечный тракт, систему крови, плод.
Патогенез ПЭ
Существует несколько десятков этиопатогенетических теорий о возникновении ПЭ, однако ни одна из них не объясняет в полной мере многообразие происходящих при данной патологии беременности морфофункциональных изменений и клинических манифестаций. В качестве основы и первопричины формирования ПЭ были изучены генетические, иммунологические, сосудистые и гуморальные факторы. По мнению многих исследователей, развитие ПЭ у беременных является результатом множества патогенетических факторов [11].
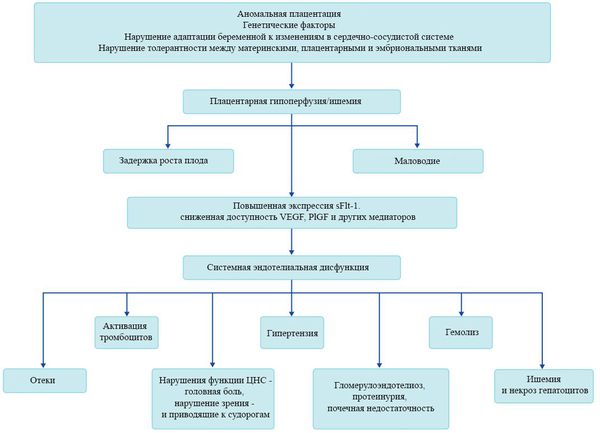
В настоящее время считается, что развитие ПЭ имеет две стадии. На первом этапе происходит неполное ремоделирование спиральной артерии в матке, которая способствует плацентарной ишемии, а на второй стадии – высвобождение ангиогенных факторов из ишемической плаценты в материнское кровообращение, что приводит к повреждению эндотелия [12, 13] (рис. 1). Клинические симптомы ПЭ возникают в результате развития эндотелиальной дисфункции в организме беременной вследствие оксидативного стресса, вазоспазма, гипоксически-ишемических изменений органов-мишеней [14, 15].
Одной из важнейших задач современной медицины является определение групп риска развития ПЭ, а также своевременная дифференциальная диагностика. Скрининг и ранее выявление женщин с риском ПЭ может обеспечить надлежащее применение дородового наблюдения и лечение [16]. На сегодняшний день скрининг ПЭ состоит из оценки клинического риска таких факторов, как возраст, индекс массы тела, семейная история, в сочетании с ультразвуковым исследованием для выявления группы высокого риска на ранних сроках беременности и проведения профилактического лечения. К сожалению, прогностическая значимость этих факторов не велика [17]. Поэтому для диагностики ПЭ используют материнские сывороточные маркеры, измерение которых является чрезвычайно эффективным при прогнозировании ПЭ.
Прогностические маркеры развития преэклампсии
Биомаркеры ПЭ условно разделяют на четыре основные группы (рис. 2) [18]. Продуцирование и уровни биомаркеров зависят от генетических факторов. Однако в отличие от статического генома, протеом является динамическим. В то время как геном не изменяется во время беременности или при связанной с беременностью ПЭ, протеом претерпевает изменения. Поэтому для оценки риска ПЭ используют определение протеомных и метаболических биомаркеров и их уровни.
Ангиогенные факторы
Плацентарное кровообращение представляет собой динамическую сеть кровеносных сосудов, которая во время беременности изменяется в соответствии с потребностями растущего плода. Плацентарный ангиогенез (процесс образования новых кровеносных сосудов в органе или ткани, в процессе которого происходит реорганизация капиллярной сети) тщательно регулируется путем баланса между проангиогенными и антиангиогенными факторами. На ранних сроках беременности трофобласты проникают в плаценту, что приводит к ремоделированию спиральных артерий и обеспечивает свободный приток крови к плоду. При ПЭ цитотрофобластическая инвазия спиральных артерий нарушается, из-за чего они становятся узкими и ограничивают кровоснабжение плода. По мере развития беременности последствия ограниченного кровоснабжения становятся более значимыми. Нарушение кровоснабжения и питания приводит к ишемии плаценты, что способствует высвобождению различных факторов плаценты и про- и антиангиогенных факторов. Некоторые из них могут выступать в качестве биомаркеров при ПЭ [19].
Проангиогенные маркеры
Проангиогенные факторы представлены сосудистым эндотелиальным фактором роста (Vascular Endothelial Growth Factor, VEGF) и плацентарным фактором роста (Placental Grows Factor, PlGF), которые стимулируют рост сосудов и принимают участие в формировании плацентарного кровообращения.
Сосудистый эндотелиальный фактор роста. Семейство VEGF состоит из пяти родственных белков: VEGF-A, VEGF-B, VEGF-C, VEGF-D, VEGF-Е и плацентарного фактора роста. Лучше всего изучен VEGF-A, который в литературе называют просто VEGF. VEGF является стимулятором ангиогенеза, повышает проницаемость сосудов внутри плацентарного ложа, регулирует дифференцировку, пролиферацию и инвазию клеток цитотрофобласта во время плацентации. Возрастание уровня VEGF при физиологической беременности свидетельствует о вовлечении его в процесс развития сосудов плаценты. У пациенток, беременность которых осложняется ПЭ, отмечается нарушение VEGF с начала 2-го триместра беременности и характеризуется достоверно низкими его показателями в течение всего периода гестации.
Плацентарный фактор роста – это гликопротеин с молекулярной массой 45-50 кДа, продуцируемый синцитиотрофобластом [20, 21]. Относится к семейству VEGF и имеет с ним 42% гомологии. Ген находится на длинном плече 14q24 хромосомы и кодирует четыре изоформы PlGF 1-4, включающие соответственно 131, 152, 203 и 224 аминокислоты. Основным различием между этими четырьмя изоформами является то, что PlGF‑1 и PlGF‑3 не имеют гепарин-связывающего участка, в то время как PlGF‑2 и PlGF‑4 имеют дополнительный гепарин-связывающий домен [22]. PlGF экспрессируется плацентарной тканью, клетками хориокарциномы и эндотелиальными клетками [23]. При нормально протекающей беременности продукция PlGF начинается с 8-10-й недели гестации и характеризуется резким увеличением, достигая своих самых высоких значений к 28-30-й неделе, а к концу беременности спадает.
Референтные значения PlGF для небеременных женщин – 20,3-85,9 (пг/ мл), для беременных – представлены в табл. 2.
У женщин с развившейся впоследствии ПЭ отмечено снижение концентрации PlGF уже на 13-16-й неделях гестации [24]. Пограничный уровень PlGF, являющийся границей между нормально протекающей беременностью и ПЭ на сроке беременности 15-18 недель, составляет 42,7±23,2 пг/мл (без признаков ПЭ – 80,6±35,2 пг/мл). Таким образом, прогностическим маркером ПЭ является уровень PlGF в сыворотке крови 50-100 пг/мл, который служит ранним, ценным маркером при диагностике этого заболевания, поскольку показывает начальные признаки нарушений в фетоплацентарном комплексе, возникающие задолго до клинической плацентарной недостаточности.
Антиангиогенные маркеры
Неотъемлемой частью нормального ангиогенеза является продукция антиангиогенных факторов, которые характеризуются высокой специфической экспрессией на эндотелии. К ним относятся s-Flt‑1 или растворимая fms-подобная тирозинкиназа‑1, VEGF-R2, VEGF‑3 и эндоглин. Растворимые формы этих рецепторов способны связывать сосудистые факторы роста в циркуляции крови, замедляя или блокируя процессы ангиогенеза.
Растворимая fms-подобная тирозинкиназа‑1. Факторы семейства VEGF взаимодействуют с клеткой через тирозинкиназные рецепторы. Рецептор VEGF 1-го типа (VEGF-R1, Flt‑1) экспрессируется гемопоэтическими стволовыми клетками, моноцитами, макрофагами и эндотелиальными клетками сосудов. sFlt‑1 представляет собой гликозилированный белок с молекулярной массой 90-100 кДа. Является усеченным сплайс-вариантом мембраносвязанного Flt‑1 (трансмембранный рецептор VEGF), свободно циркулирует в плазме, действуя как рецептор-«ловушка» для VEGF и PlGF, и выступает в роли их мощного антагониста (рис. 3). В результате этих свойств sFlt‑1 проявляет антиангиогенный эффект [25].
В исследованиях была обнаружена связь между повышенными уровнями sFlt‑1 и ПЭ. Уже за 5-6 недель до начала ПЭ уровни sFlt‑1 увеличиваются и остаются повышенными по сравнению с нормальной физиологической беременностью. В 2003 году белок sFlt‑1 был предложен в качестве возможного фактора, повреждающего эндотелий при беременности [26, 27].
Определение содержания PlGF и sFlt‑1 в кровотоке матери позволяет прогнозировать развитие ПЭ, поскольку эти показатели отражают дисбаланс между проангиогенными и антиангиогенными факторами. Обнаружено достоверное снижение PlGF и увеличение концентрации sFlt‑1 у беременных с ПЭ по сравнению со здоровыми беременными (рис. 4).
В последнее время в лабораторную практику начали внедрять определение соотношения sFlt‑1/PlGF с целью диагностики и краткосрочного прогнозирования развития ПЭ у беременных женщин. По данным многих авторов, соотношение уровней sFlt‑1 и PlGF оказалось более надежным прогностическим и диагностическим маркером ПЭ, чем каждый из этих показателей в отдельности 28.
Соотношение sFlt‑1/PlGF. Изменения маркеров sFlt‑1 и PlGF наблюдается уже во 2-м триместре беременности, что позволяет использовать соотношение sFlt‑1/PlGF для диагностки и прогнозирования ПЭ. Подтверждением ПЭ являются предельные значения соотношения sFlt‑1/PlGF >85 (срок беременности от 20+0 до 35+6 недель) и sFlt‑1/PlGF >110 (34+0 недель до родов) [31]. Повышенное соотношение sFlt‑1/PlGF отражает патологию неэффективной плацентации, плацентарной ишемии и считается перспективным биомаркером для прогнозирования и диагностики заболевания [32]. В 2016 году этот анализ был рекомендован Национальным институтом клинического совершенствования (National Institute for Clinical Excellence, NICE) для исключения ПЭ у пациенток с подозрением на данную патологию [33]. Кроме того, соотношение может также применяться для прогнозирования эклампсии и HELLP-синдрома.
Растворимый эндоглин (sEng)
Растворимый эндоглин представляет собой усеченную форму рецепторов трансформирующих факторов роста TGF-β1 и TGF-β3. Он является потенциальным антиангиогенным фактором, который препятствует связыванию TGF-β1 с его рецептором и тем самым влияет на выработку оксида азота (NO), вазодилатацию и образование капилляров эндотелиальными клетками [34]. Эндоглин участвует в регуляции основных клеточных процессов, включая пролиферацию, дифференцировку, миграцию, апоптоз, адгезию, организацию цитоскелета и ремоделирование внеклеточного матрикса. Растворимая изоформа эндоглина связывает циркулирующий TGF-β, так как содержит TGF-β-связывающий домен. TGF-β является проангиогенной молекулой, но при повышенном уровне sEng он утрачивает свои свойства и инактивируется. sEng играет большую роль в развитии дисфункции эндотелия и в патогенезе ПЭ. Было показано, что sEng увеличивается при ПЭ, причем уровень sEng коррелирует с тяжестью заболевания и снижается после родов. При нормальной беременности уровни sEng снижаются между 1-м и 2-м триместрами и повышаются во 2-м триместре у пациенток с предрасположенностью к ПЭ [35].
Другие биомаркеры преэклампсии
Протеин А плазмы, ассоциированный с беременностью (PAPP-A)
PАPP-А – это большой высокогликозилированный белок, относящийся к цинксодержащим ферментам (металлопротеиназам), который синтезируется трофобластами [36]. PAPP-А отщепляет от инсулиноподобного фактора роста белковые фрагменты и повышает его биологическую активность. Благодаря этому процессу обеспечивается полноценный рост и развитие плаценты. Его содержание в крови увеличивается при физиологической беременности. Снижение уровня PАРР-А в плазме крови отмечается в 1-м триместре беременности, связаной с ПЭ [37]. По данным многих исследователей, сывороточные уровни PАРР-А и PlGF – два наиболее изученных биохимических маркера, которые возможно использовать для раннего прогнозирования ПЭ 39.
Плацентарный белок 13 (РР‑13)
Плацентарный белок РР‑13 – относительно небольшой димерный белок с молекулярной массой 32 кДа. Представитель суперсемейства галектинов (галектин 13), секретируется в большом количестве в плаценте. При нормальной беременности уровень PP‑13 постепенно увеличивается до момента родов. Снижение концентрации РР‑13 в сыворотке крови в 1-м триместре прогнозирует ПЭ как у беременных с умеренным и низким уровнем риска, так и у беременных высокого риска [41, 42].
Ингибин А и активин А
Ингибин А и активин А являются гликопротеинами и относятся к семейству трансформирующих факторов роста β. Оба в значительной степени выделяются фетоплацентарной единицей во время беременности. Ингибин А играет важную эндокринную роль, участвуя в процессах регуляции отрицательной обратной связи гонадотропинов, а активин А действует на различные биологические процессы [43]. Основным источником этих циркулирующих белков явялется плацента. Концентрации ингибина А и активина А увеличиваются в 3-м триместре у пациенток с физиологической беременностью. При тяжелой ПЭ их уровни повышаются примерно в 10 раз [44]. При ПЭ наблюдается повышение окислительного стресса и системное воспаление, что стимулирует выработку активина А и его секрецию плацентарными эксплантами и эндотелиальными клетками [45].
Пентраксин‑3 (PTX3)
Пентраксины – это семейство эволюционно консервативных белков. В зависимости от их первичной структуры они делятся на короткие (25 кДа) и длинные (40-50 кДа). Короткие пентраксины, такие как С-реактивный белок, вырабатываются печенью, длинные пентраксины (пентраксин‑3) экспрессируются сердцем. Пентраксин‑3 (фактор некроза опухоли – стимулируемый ген‑14) состоит из 318 аминокислот, представитель суперсемейства пентраксина, включающего С-реактивный белок и сывороточный Р-компонент амилоида [46]. Синтезируется в ответ на провоспалительное действие и секретируется клетками различных типов, включая макрофаги, нейтрофилы, клетки яичника, эндотелиальные клетки, фибробласты, альвеолярные, эпителиальные и глиальные клетки. Пентраксин‑3 – острофазный белок, уровень которого в плазме возрастает при воспалении и различных инфекциях. При ПЭ в ответ на воспаление его уровни повышаются [47].
Дизинтегрин и металлопротеиназа‑12 (ADAM‑12)
Дизинтегрин и металлопротеиназа‑12 является цинк-зависимой мембраносвязанной протеазой, представителем семейства ADAM группы белков, принимающих участие в межклеточных взаимодействиях при оплодотворении. Для гена, кодирующего ADAM, свойствен альтернативный сплайсинг, в результате которого образуются две формы белка. Недавние исследования обнаружили связь между повышенным уровнем ADAM‑12 и ПЭ [48].
МикроРНК
МикроРНК – это класс нуклеоидных коротких последовательностей РНК, которые не участвуют в синтезе белка. МикроРНК задействованы в механизме посттранскрипционной экспрессии генов: связываясь со специфическими участками матричных РНК в цитоплазме, они обеспечивают репрессию трансляции или деградацию транскриптов мишеней. МикроРНК могут регулировать до 60% генома человека. Способны управлять сложными процессами, такими как рост клеток, дифференцировка, стресс-реакция и ремоделирование тканей, что при определенных условиях может играть ключевую роль при многих патологических процессах, включая ПЭ. В последнее время особое внимание уделяется определению уровней микроРНК как возможному предиктору ПЭ на ранних сроках [49].
Лептин
Лептин представляет собой белок, состоящий из 167 аминокислот, он относится к цитокинам и имеет общую молекулярную массу 16 кДа. Лептин играет важную роль в некоторых физиологических процессах, включая размножение, ангиогенез, воспаление и регуляцию эндокринной и иммунной функций. Основным источником лептина является жировая ткань, но во время беременности лептин также продуцируется плацентой. При нормальной беременности экспрессия плацентарного лептина увеличивается по сравнению с таковой у небеременных и поддерживает имплантацию, выработку гонадотропина человека, рост плаценты и митогенез. Дисрегуляция уровня лептина может указывать на гестационные осложнения или приводить к ним. По данным ряда авторов, уровень лептина повышается при ПЭ по сравнению с женщинами с физиологическим течением беременности [50, 51]. В связи с этим лептин может быть потенциальным биомаркером для прогнозирования ПЭ и выступать как инструмент скрининга на ранних сроках гестации.
Чемерин
Чемерин – сравнительно недавно обнаруженный адипокин, который участвует в патогенезе ожирения и воспаления. Было показано, что его уровень может резко возрастать в 1-м триместре беременности и служить маркером ПЭ [52, 53].
Цистатин С
Цистатин С является хорошо исследованным маркером функции почек. Цистатин С – негликозилированный белок с молекулярной массой 13,4 кДа, относится к семейству ингибиторов цистеиновых протеиназ, идентичен пост-γ-глобулину. Впервые был идентифицирован у пациентов с почечной недостаточностью. Цистатин С с постоянной скоростью синтезируется клетками, содержащими ядра, полностью метаболизируется в почках, свободно фильтруется через клубочковую мембрану, не секретируется проксимальными почечными канальцами. Плацентарная экспрессия цистатина С увеличивается при развитии ПЭ, что может приводить к повышенному уровню цистатина С в плазме крови [54].
Адипонектин
Адипонектин – это выделенный из адипоцитов коллагеноподобный белок, обладающий инсулинсенсибилизирующими, антиатерогенными и противовоспалительными свойствами, который участвует в патогенезе ожирения. Экспрессия адипонектина происходит исключительно в жировой ткани. Многочисленные исследования последних лет подтверждают повышение уровня адипонектина у женщин с ПЭ [55].
Висфатин
Висфатин – недавно обнаруженный адипокин массой 52 кДа, вовлеченный в регуляцию гомеостаза глюкозы и выступающий как маркер эндотелиальной дисфункции. Hu W. и соавт. [56] в своем исследовании обнаружили низкую концентрацию висфатина при ПЭ. Кроме того, было показано, что беременные с тяжелой ПЭ имели значительно более низкую концентрацию висфатина в сыворотке крови, чем те, у которых ПЭ была умеренной.
Матриксная металлопротеиназа‑2 (ММР‑2)
Матриксная металлопротеиназа‑2 экспрессируется в мезенхимальных клетках (в основном в фибробластах) в период развития и репарации ткани, а также синтезируется нейтрофилами, макрофагами и моноцитами. Имеются указания на то, что на развитие осложнений беременности, в том числе и ПЭ, влияют как избыточная продукция протеаз, так и их недостаток. В ряде работ было показано, что MMP‑2 значительно выше в сыворотке крови у женщин с ПЭ по сравнению с небеременными или при физиологически протекающей беременности.
Аполипопротеин Е (ApoE)
Одним из механизмов развития ПЭ является нарушение метаболизма липидов, связанное с окислительным стрессом. Женщины с ПЭ имеют аномальный липидный профиль с повышенными концентрациями липопротеинов, богатых триглицеридами, которые могут способствовать эндотелиальной дисфункции. ApoE является основным компонентом липопротеинов очень низкой плотности, роль которого заключается в изменении воспалительных реакций и удалении избыточного холестерина из кровообращения посредством регуляции поглощения в печени. Ген ApoE на 19-й хромосоме имеет 3 общих аллеля, кодирующих 3 изоформы ApoE в плазме, – e2, e3 и e4. Было высказано предположение, что уровни ApoE и полиморфизмы его гена связаны с повышенным риском ПЭ. Обнаружена более высокая частота аллеля ApoE e2 среди женщин с ПЭ по сравнению с контрольной группой [57]. Эти данные не были подтверждены в других исследованиях [58, 59]. Роль данного направления исследований в прогнозировании ПЭ в настоящее время считается неопределенной.
Внеклеточная ДНК (вкДНК)
Фрагменты ДНК, циркулирующие в межклеточной среде организма, называют внеклеточной ДНК [60]. Существует несколько гипотез о происхождении вкДНК, основными из которых являются образование пула внеклеточных нуклеиновых кислот в результате гибели клеток («гипотеза клеточной гибели») и активная секреция ДНК живыми клетками («гипотеза метаболической ДНК») [61]. Повышенный интерес к вкДНК связан с возможностью ее использования в качестве маркера для диагностики. В составе вкДНК, выделенной из плазмы или периферической крови, обнаруживается ДНК плода (при беременности), что позволяет анализировать геном плода, не прибегая к биопсии.
Недавно была изучена связь между фетальной ДНК и ПЭ. В группе пациенток с высоким риском развития ПЭ наблюдалось более высокое содержание фетальной ДНК [62, 63]. Другие исследователи [64] наблюдали увеличение в 5 раз вкДНК плазмы у женщин с ПЭ по сравнению с беременными контрольной группы. Из 13 исследований, в которых определяли количество вкДНК для прогнозирования ПЭ, в 11 обнаружили более высокое содержание вкДНК [65].
Таким образом, за последнее десятилетие появился целый ряд перспективных и интересных биохимических маркеров, которые могут быть использованы для своевременной и ранней диагностики группы риска, т. е. выявления беременных, у которых вероятность развития ПЭ очень высокая (табл. 3).
Выводы
Преэклампсия – это сложное и специфическое заболевание при беременности, механизмы которого еще не полностью понятны. Считается, что центральным звеном ПЭ является системное повреждение эндотелия сосудов микроциркуляции с развитием эндотелиальной дисфункции. Однако эндотелиальная дисфункция регистрируется при многих соматических заболеваниях и патологических состояниях, таких как сахарный диабет, атеросклероз, сепсис, хронические заболевания почек, гиперлипидемия, артериальная гипертензия, легочная гипертензия и др. В связи с этим исследовано большое количество биохимических маркеров для прогнозирования ранней диагностики и оценки степени тяжести ПЭ. Однако ни один из них официально не рекомендован к практическому применению в связи с достаточно низкой чувствительностью и специфичностью для ПЭ. Более того, определение уровня лишь одного какого-либо маркера не позволяет получить полноценную информацию о всех функциях эндотелия, нарушенных при ПЭ в той или иной степени.
Результаты современных исследований свидетельствуют о том, что лучшей предсказательной ценностью обладает сочетание клинических данных и биохимических параметров. На сегодняшний день поиск как клинических данных, так и лучших по своей предсказательной ценности биомаркеров продолжается, оставаясь одной из главных тенденцией научных исследований в акушерстве и гинекологии, учитывая тяжесть этого осложнения беременности.
Cписок литературы находится в редакции.
Тематичний номер «Гінекологія, Акушерство, Репродуктологія» № 2 (34), червень 2019 р.
СТАТТІ ЗА ТЕМОЮ Акушерство/гінекологія
Представляємо вашій увазі результати дослідження U.V. Ukah, R.W. Platt et al. (2020), у якому встановлено, що наявність в анамнезі у жінки акушерської кровотечі є фактором ризику виникнення у неї в подальшому серцево-судинного захворювання. Особливо високий ризик виникнення серцево-судинного ускладнення виявлено у пацієнток із кровотечею, яким було проведено переливання крові. На підставі отриманих даних важливо дослідити можливості кардіопрофілактики в осіб із акушерськими кровотечами.