маленькие фолликулы в яичнике что это значит
«Резерв фолликулов в яичниках может исчерпаться уже к 30 годам, и тогда забеременеть не получится». Интервью с гинекологом
Что такое овариальный резерв, почему о нем важно знать, какие анализы нужно сдать, чтобы определить количество фолликулов, без которых невозможна беременность, и кто находится в зоне риска? На эти вопросы нам ответила врач акушер-гинеколог Тамара Слукина.
Все начинается еще до рождения девочки
— Тамара Владимировна, все чаще говорят о том, что первого ребенка женщины решаются родить лишь примерно с 27 лет, так ли это?
— Да, действительно, такая тенденция существует, и она не очень радует гинекологов. В последнее время отмечается смещение возрастных границ для первородящих.
— Почему так происходит?
— Причин много: урбанизация, желание получить высшее образование (а иногда даже два), состояться в социальном и профессиональном плане, удостовериться в правильном выборе партнера и так далее.
— Какой возраст считается самым благоприятным для беременности?
— Определенно, лучшее время для первой беременности — до 25 лет, когда организм крепкий и здоровый, когда нет серьезных приобретенных болезней и минимально пагубное влияние стрессовых факторов.
— Что такое фолликул и овариальный резерв?
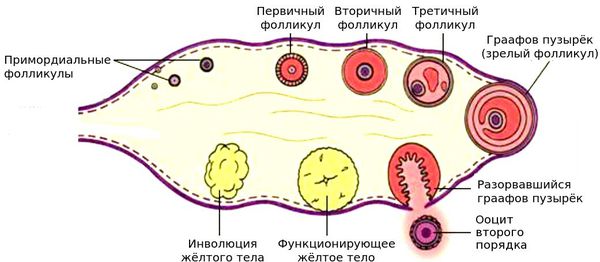
— Фолликул — это структурный компонент яичника, состоящий из яйцеклетки, окруженной слоем эпителиальных клеток и двумя слоями соединительной ткани. Он выполняет защитную функцию для яйцеклетки, а также гормональную.
Овариальным резервом называют запас имеющихся в яичнике фолликулов, способных развиваться далее и делающих возможным овуляцию яйцеклетки.
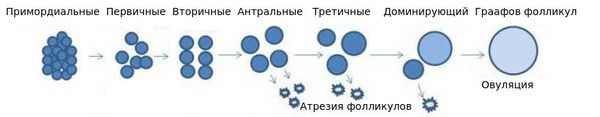
К сожалению, число фолликулов конечно. Еще в утробе приблизительно к 19-20 неделе в яичниках плода начинают формироваться оогонии, то есть предшественники фолликулов. Их закладывается порядка 7 миллионов, к моменту рождения девочки количество сокращается уже до 1,5-2 миллионов. К периоду первой менструации остается не более 300-350 тысяч, и постепенно количество уменьшается.
Наивысшая генеративная активность, то есть реализация максимального числа яйцеклеток, биологически запрограммирована на третье десятилетие жизни женщины.
Вероятность забеременеть после 30 сокращается вдвое
— Какое количество фолликулов говорит о том, что у женщины хороший запас и пока беспокоиться не стоит?
— Примерно 5-15 фолликулов размером от 3 до 5 мм считается нормальным. Если их меньше, ситуацию можно назвать критичной и стоит обязательно обратить внимание на этот вопрос.
— Правда ли, что сегодня резерв у женщин заканчивается намного раньше, чем, например, лет десять назад?
— Паниковать пока рано. Если исходить из личного опыта, я бы не сказала, что ситуация становится очень критичной, но до 30 лет вероятность забеременеть самая высокая и, желательно, конечно, чтобы первые роды прошли в этот период.
По статистике, количество фертильных женщин за отметкой в 30 лет сокращается ровно наполовину, то есть вероятность забеременеть значительно снижается. Еще сложнее ситуация с новым десятком: в возрасте 40-43 лет количество представительниц прекрасного пола, способных забеременеть, — уже 10-15%. Ну, а среди 50-летних дам — это и вовсе уникальные случаи.
Точно оценить овариальный резерв сегодня не проблема
— Почему природа так неравноценно распределила: у одних резерв больше, у других — меньше?
— Таковы генетические программы. Кому-то повезло, а кому-то — нет. Повлиять на это, каким-то образом увеличить запас организма нельзя. Как я уже говорила, процесс необратим.
— Какие существуют методы определения овариального резерва?
— Есть 3 составляющие: проверка АМГ, подсчет количества фолликулов на УЗИ, а также определение размера (объема) яичников.
Определение антимюллерова гормона (АМГ) по анализу крови. Это белок, продуцирующийся в гранулезных клетках фолликула. Как правило, показатель выше 2,5 нг/мл считается нормой.
Показания УЗИ. Собственно подсчет фолликулов и определение объема яичников (если они меньше 4 см, то есть вероятность, что овариальный резерв маловат).
Поговорите с мамой и старшими сестрами. Предрасположенность к раннему климаксу — очень важный фактор
— Как часто нужно делать специальные обследования, чтобы держать ситуацию под контролем?
— В зоне риска женщины, перенесшие операции, лучевую терапию, химиотерапию, воспалительные процессы, затрагивающие репродуктивные органы, и особенно, если есть эндометриоз. Им стоит быть очень внимательными.
Что касается остальных, скажем так, по протоколу, после 35 лет женщина должна делать УЗИ каждый год. Ранее — только по определенным показаниям. Но никто не мешает вам обследоваться и раньше, чтобы просто удостовериться, что все хорошо. Сделать это можно хотя бы для исключения синдрома аномального истощения яичников — прекращения выработки яйцеклеток, опередившее процесс старения, который развивается на фоне наследственной предрасположенности. В таких случаях резерв может быть крайне критичным даже к 30-35 годам.
Если у вашей мамы или у старших сестер был очень ранний климакс, значит высока вероятность, что и вы пойдете по тем же стопам. Еще один важный сигнал — частые сбои менструального цикла. Его нельзя игнорировать.
К сожалению, сильное пагубное влияние сегодня оказывает экология и вообще все, что нас окружает. Возьмем хотя бы обычные пластиковые бутылки, в которых содержится бисфенол. Под действием температуры выше 35 градусов он становится эстрогеноподобным. Если такое вещество попадает в организм женщины, оно оказывает крайне негативное влияние на фолликулы. То есть полежала бутылочка на солнышке — и вот еще один негативный фактор в копилку. В некоторых странах подобные тары уже запрещены.
— Главный вопрос: что со всем этим делать?
— Необходимо как минимум вовремя обратить внимание на проблему. Не стоит ее очень сильно пугаться и паниковать. Ненадолго приостановить процесс врачи все-таки могут. Как правило, с помощью гормональных препаратов.
О профилактике тоже можно говорить. Избегайте абортов, любых воспалительных процессов, если уж они возникают, обязательно обращайтесь к врачам, не затягивайте. Будьте внимательны к себе и своему здоровью.
Что такое снижение овариального резерва? Причины возникновения, диагностику и методы лечения разберем в статье доктора Каменецкого Б. А., репродуктолога со стажем в 30 лет.
Определение болезни. Причины заболевания
Распространение вспомогательных репродуктивных технологий привело к тому, что овариальный резерв и его снижение рассматриваются с позиций ответа яичника на воздействие гонадотропных препаратов. Гонадотропины — группа препаратов, оказывающих влияние на половые железы, в том числе способствующие созреванию фолликулов в яичниках. Нормальный овариальный резерв — адекватному ответ яичников на стимуляцию. Под адекватным ответом понимается требуемый рост фолликулов и получение достаточного количества ооцитов. Достаточное количество определяется не столько числом получаемых ооцитов, сколько количеством полученных после оплодотворения эмбрионов с правильным хромосомным набором.
В зависимости от возраста женщины для получения одного нормального эмбриона требуется разное количество ооцитов:
Причины развития СОР можно условно разделить на две группы:
Симптомы снижения овариального резерва
Снижение овариального резерва — процесс, растянутый во времени, которые чаще всего протекает без симптомов. Причиной, заставляющей женщину обратиться к врачу, является отсутствие беременности (бесплодие).
Патогенез снижения овариального резерва
К другим причинам, оказывающим негативное влияние на уровень овариального резерва, относятся:
Классификация и стадии развития снижения овариального резерва
С накоплением данных стало понятно, что в группу пациентов со сниженным овариальным резервом, а как следствие с неадекватным ответом на стимулирующую терапию, включены женщины с разными причинами возникновения и механизмами развития патологии. Это затрудняло планирование адекватной терапии. В связи с этим в 2016 году была сформирована рабочая группа POSEIDON ( Patient-Oriented Strategies Encompassing Individualize Oocyte Number) [37] по разработке новых критериев и классификации пациентов со сниженным овариальным резервом и бедным ответом яичников на стимуляцию.
Чтобы представить более детальную картину, были предложены клинически значимые критерии, которые могут помочь врачу в ведении пациентов. Для определения групп с низким прогнозом на стимуляцию предложены две новые категории [37] :
Первая группа включает количество получаемых при стимуляции ооцитов:
Вторая группа объединяет «качественные» и «количественные» параметры, а именно:
В результате введения этих категорий выделяют четыре группы пациентов со сниженным овариальным резервом и низким ответом на стимулирующую терапию:
Выделение отдельных групп решает практическую задачу — планирование терапии с учётом детальных критериев для пациентов разных этиопатогенетических групп.
Осложнения снижения овариального резерва
Вторым по значимости осложнением является преждевременное истощение яичников и, как следствие, нарушение менструальной функции вплоть до её полного угасания. Снижение овариального резерва приводит к критическому снижению количества ооцитов и нарушение менструального цикла по типу:
Диагностика снижения овариального резерва
Диагностика строится на совокупности анамнестических и клинико-лабораторных данных. Наиболее важным является возраст. Клинические проявления снижения овариального резерва зачастую начинают проявляться после 35 лет.
Очень часто в анамнезе есть упоминания о раннем наступлении климакса у ближайших родственников по женской линии (мать, старшие сестры).
Основными жалобами являются нарушение (чаще сокращение продолжительности и интенсивности) менструального цикла и бесплодие.
Из объективных критериев:
Лечение снижения овариального резерва
Патогенетического лечения не существует. Терапия направлена прежде всего на устранение последствий снижения овариального резерва, а именно преодоления бесплодия.
В программах вспомогательной репродукции в зависимости от принадлежности пациентки к той или иной группе по критериям POSEIDON рассматриваются различные стратегии стимулирующей терапии для получения большего количества ооцитов.
Для первой и второй групп применяется пять основных стратегий отдельно или в комбинациях:
Стратегии, предложенные для стимуляции пациенток третьей и четвёртой групп:
При невозможности получения достаточного количества ооцитов рекомендовано использование донорских ооцитов.
Прогноз. Профилактика
Для профилактики бесплодия рекомендовано:
Профилактика ятрогенных осложнений:
Синдром пустых фолликулов
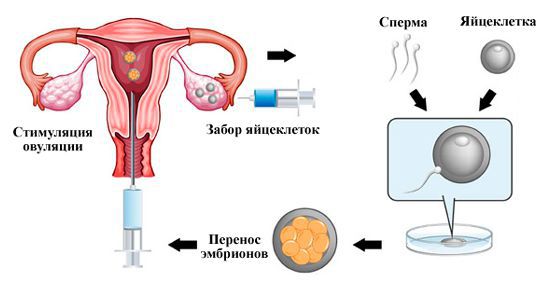
Процедура ЭКО (экстракорпоральное оплодотворение) — это современный и многоэтапный процесс, который позволяет получить беременность и ребенка в тех случаях, когда физиологическое наступление беременности невозможно. При проведении экстракорпорального оплодотворения могут возникать проблемы, одной из которых является синдром пустого фолликула.
Стаж работы 11 лет.
Что такое синдром пустых фолликулов
Может ли фолликул быть пустым? Синдром пустых фолликулов — это патологическое состояние, которое возникает при проведении протокола экстракорпорального оплодотворения, при котором после пункции фолликулов в фолликулярной жидкости не обнаруживается яйцеклеток.
При физиологическом состоянии женской репродуктивной системы фолликулы растут, созревают, в них формируется зрелая яйцеклетка. При стимуляции овуляции таких фолликулов может быть несколько (от двух до двадцати и более). После пункции в протоколе экстракорпорального оплодотворения из каждого фолликула получают фолликулярную жидкость, в которой присутствуют ооциты. Если же при пункции фолликулы пустые, то есть, в них нет половых клеток женщины, тогда можно говорить о присутствии синдрома пустых фолликулов.
Чем моложе женщина, тем меньше риск формирования такого патологического состояния. У молодых девушек риск формирования такого состояния составляет до 1%. С возрастом этот показатель может увеличиваться до 9%.
Впервые такое состояние было выявлено врачом-репродуктологом Каролиной Калам в 1986 году. Именно этот специалист разделил синдром пустых фолликулов на два вида: истинный и ложный синдром пустых фолликулов.

Причины пустых фолликулов
Почему в фолликуле нет яйцеклетки? Точных причин, почему возникает пустой фолликул без яйцеклетки, на данный момент нет. Существует несколько предположений, которые могут привести к соответствующим нарушениям в репродуктивной системе женского организма.

Как диагностируют синдром пустых фолликулов?
Может ли быть фолликул без яйцеклетки быть выявлен заранее?
Мнение врача
К сожалению, пустой фолликул диагностировать до пункции нельзя ни проведением измерений базальной температуры, ни при помощи ультразвукового исследования. Диагноз ставится только на основании изучения фолликулярной жидкости после проведения процедуры его пунктирования.
Врач репродуктолог, акушер-гинеколог.
Некоторые специалисты настаивают на том, что синдром пустых фолликулов не является отдельным заболеванием, а лишь следствие каких-либо патологий.
Чтобы диагностировать истинный синдром пустых фолликулов, необходимо исключить причины, которые могли бы повлиять на формирование такого состояния:
Терапия при синдроме пустых фолликул
Если диагностировано отсутствие фолликулов в яичниках, необходимо предпринимать меры для выявления влияния факторов и причин такого состояния, а в последующем исключить их воздействие на организм женщины. После этого проводится повторная гормональная нагрузка на яичники с последующей повторной пункцией фолликулов.
Если же и при повторной процедуре в фолликулярной жидкости не обнаруживается ооцитов, тогда необходимо предпринимать следующие меры:
Синдром пустых фолликулов не является приговором. При грамотном подборе гормональной стимуляции и исключении всех факторов риска наступление беременности в протоколе ЭКО не заставит себя долго ждать. Ведь истинный синдром пустых фолликулов встречается достаточно редко.
Что делать, если нет яйцеклеток даже после применения всех мер?
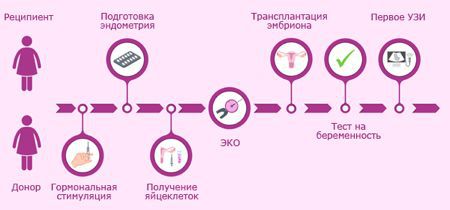
Если были выполнены все рекомендации и в итоге нет ооцитов в фолликуле или нет фолликулов в яичниках, то современные вспомогательные репродуктивные технологии могут помочь вам в обретении счастья материнства.
В современных центрах есть криобанки, в которых вы сможете подобрать донорские яйцеклетки. Сотрудники центра помогут подобрать клетки от такого донора, который имеет максимальные фенотипические (внешние) сходства с вами.
Данная статья не может быть использована для постановки диагноза, назначения лечения и не заменяет прием врача.
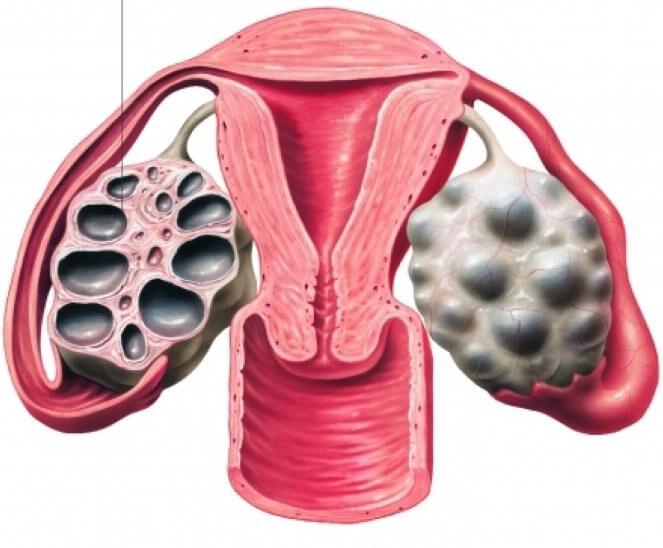
Синдром поликистозных яичников или мультифолликулярные яичники
Врачи на УЗИ нередко видят достаточно типичную картину, которую называют мультифолликулярными яичниками. Для некоторых пациенток мультифолликулярные яичники — синоним поликистоза, при котором также много фолликулов. Между тем, это совершенно разные понятия.
Для начала опишем УЗИ-картину яичников при поликистозе:
Однако описанная картина иногда бывает лишь ошибочно похожа на поликистозные яичники. Например, весьма похожая картина может быть в 1 фазе цикла (на 5-7 день) вследствие чисто физиологических изменений, которые естественно протекают в половой системе женщины. Кроме того, подобные изменения бывают у женщин на фоне длительного приема оральных контрацептивов, в рамках гипогонадотропной аменореи и, наконец, у девушек в периоде полового созревания.
Таким образом, мультифолликулярные яичники — лишь ультразвуковой симптом менструального цикла в рамках нормы. Однако, учитывая, что картина может быть нечеткой, что есть определенные варианты течения поликистоза яичников, при выявлении картины мультифолликулярных яичников необходимо провести дифференциальную диагностику. Для этого исследуют содержание в крови ЛГ и ФСГ, тестостерона, инсулина. При мультифолликулярных яичниках уровень этих гормонов находится в пределах нормы. А при поликистозе яичников соотношение ЛГ/ФСГ больше 2,5-3, увеличен уровень общего и свободного тестостерона, а также инсулина. Кроме того, о наличии поликистозных яичников свидетельствует также и клиническая картина заболевания.
То же относится и к девушкам периода полового созревания, у которых состояние называют также «формирующийся синдром поликистозных яичников». У них специфическую ультразвуковую картину сопровождают специфические гормональные и внешние изменения.
Таким образом, мультифолликулярные яичники — диагноз не заболевания, а определенного состояния, которое само по себе не является причиной бесплодия, нарушений менструального цикла и т.д. Но проводить дифференциальный диагноз с более тяжелыми состояниями все-таки необходимо.
Для дифференциальной диагностики мультифолликулярных и поликистозных яичников можно использовать следующие признаки:
Часто мультифолликулярные яичники принимают за поликистозные яичники, однако мультифолликулярные яичники следует рассматривать как вариант нормы, а поликистоз яичников — заболевание.
Женские половые органы – яичники, маточные трубы, матка, подвержены изменениям в зависимости от фазы менструального цикла. В начале менструального цикла в яичниках начинают созревать 5-7 фолликулов, но дозревает только один из них. При картине мультифолликулярных яичников одновременно дозревают более 7 фолликулов. Мультифолликулярные яичники часто встречаются в начале полового созревания, когда только устанавливается менструальная функция, у женщин длительно принимающих пероральные контрацептивы, а также на 5-7 день нормального менструального цикла. Иногда синдром мультифолликулярныхяичников может сопровождаться нарушениями менструального цикла, чаще всего это связано с недостаточностью лютеинизирующего гормона, что может быть вызвано резкой потерей веса, или наоборот его набором. При этом может наблюдаться аменорея или олигоменорея. Нарушения менструального цикла, сопровождающие мультифолликулярные яичники, может свидетельствовать о начальной стадии поликистоза яичников.
Часто, только лишь по данным УЗИ, бывает сложно отдифференцировать синдром мультифолликулярный яичников от синдрома поликистозных яичников. В таких случаях, необходимо динамическое наблюдение у гинеколога и определение гормонального фона. Однако, есть ряд УЗИ-признаков, отличающих мультифолликулярные яичники от поликистозных. Главным отличительным признаком является размер яичника, при синдроме мультифолликулярных яичников он нормальный, при поликистозных яичниках увеличен. Количество фолликулов при синдроме мультифолликулярных яичников 8-10, диаметр фолликулов 4-8 мм, приполикистозе более 10, диаметр фолликулов более 10 мм. Мультифолликулярные яичники не сопровождаются гормональными нарушениями, в отличии от поликистозных яичников.
Причины СПКЯ
СПКЯ – часто распространенное гормональное расстройство среди женщин репродуктивного возраста, приводящее к стойкому бесплодию. Несмотря на актуальнось проблемы, точные причины возникновения СПКЯ до сих пор неизвестны.
Помимо гормональных причин, к предрасполагающим факторам, ведущим к развитию СПКЯ, относят:
Симптомы СПКЯ
Молочные железы развиты правильно, у каждой третьей женщины имеет место фиброзно-кистозная мастопатия, развивающаяся на фоне хронической ановуляции и гиперэстрогении.
Практически все пациенки с СПКЯ имеют повышенную массу тела. При этом излишки жира откладываются, как правило,на животе (“центральный” тип ожирения). Поскольку уровень инсулина при СПКЯ повышен, довольно часто заболевание сочетается с сахарным диабетом 2 типа. СПКЯ способствует раннему развитию сосудистых заболеваний, таких какгипертоническая болезнь и атеросклероз.
Поскольку симптомов заболевания много, СПКЯ легко можно перепутать с любым дисгормональным нарушением. В молодом возрасте жирную кожу, угри и прыщи принимают за естественные возрастные особенности, а повышенная волосатость и проблемы с лишним весом зачастую воспринимаются как генетические особенности. Поэтому если менструальный цикл не нарушен и женщина еще не пробовала беременеть, то к гинекологу такие пациентки обращаются редко. Важно знать,что любые подобные проявления не являются нормой и при обнаружении у себя подобных симптомов следует очно проконсультироваться у гинеколога-эндокринолога.
Диагностика СПКЯ
Структурные изменения яичников при СПКЯ характеризуются:
Диагностика СПКЯ включает:
После пробы с дексаметазоном содержание андрогенов незначительно снижается, примерно на 25% (за счет надпочечниковой фракции).
Проба с АКТГ отрицательная, что исключает надпочечниковую гиперандрогению, характерную для адреногенитального синдрома. Отмечено также повышение уровня инсулина и снижение ПССГ в крови.
В клинической практике простым и доступным методом определения нарушения толерантности глюкозы к инсулину является сахарная кривая. Определяется сахар крови сначала натощак, затем — в течение 2 ч после приема 75 г глюкозы. Если через 2 ч уровень сахара крови не приходит к исходным цифрам, это свидетельствует о нарушенной толерантности к глюкозе, т. е. об инсулинрезистентности, что требует соответствующего лечения.
Критериями для постановки диагноза СПКЯ являются:
Лечение СПКЯ
Лечение СПКЯ определяется с учетом выраженности симптомов и желанием женщины забеременеть. Обычно начинают с консервативных методов лечения, при неэффективности показано хирургическое лечение.
Если у женщины имеется ожирение, то лечение следует начать с коррекции массы тела. В противном случае консервативное лечение у таких пациенток не всегда дает желаемый результат.
При наличии ожирения проводятся:
Консервативное лечение СПКЯ
При нарушенном углеводном обмене лечение бесплодия начинают с назначения гипогликемических препаратов из группы бигуанидов (Метформин). Препараты корректируют уровень глюкозы в крови, курс лечения составляет 3-6 месяцев, дозы подбирают индивидуально.
Для стимуляции овуляции применяют гормональный препарат-антиэстроген Кломифен-цитрат, который стимулирует выход яйцеклетки из яичника. Препарат применяют на 5-10 день менструального цикла. В среднем, после применения Кломифена овуляция восстанавливается у 60 % пациенток, беременность наступает у 35 %.
При отсутствии эффекта от Кломифена, для стимуляции овуляции применяют гонадотропные гормоны, такие как Пергонал, Хумегон. Стимуляция гормонами должна проводится под строгим контролем гинеколога. Эффективность лечения оценивают при помощи УЗИ и показателей базальной температуры тела. Если женщина не планирует беременность, для лечения СПКЯ назначают комбинированные оральные контрацеативы (КОК) с антиандрогенными свойствами для восстановления менструального цикла.Такими свойствами обладают КОКи Ярина, Диане-35, Жанин, Джес. При недостаточном антиандрогенном эффекте КОКов, возможно совместное применение препаратов с антиандрогенами (Андрокур) с 5 по 15-й день цикла. Лечение проводят с динамическим контролем показателей гормонов в крови. Курс лечения составляет в среднем от 6 месяцев до года.
Высоким антиандрогенным свойством обладает калийсберегающий диуретик Верошпирон, который также используют при поликистозе яичников. Препарат снижает синтез андрогенов и блокирует их действие на организм. Препарат назначают минимум на 6 месяцев.
Стимуляция овуляции при СПКЯ
Кломифен относится к нестероидным синтетическим эстрогенам. Механизм его действия основан на блокаде рецепторов эстрадиола. После отмены кломифена по механизму обратной связи происходит усиление секреции ГнРГ, что нормализует выброс ЛГ и ФСГ и, соответственно, рост и созревание фолликулов в яичнике. Таким образом, кломифен не стимулирует яичники непосредственно, а оказывает воздействие через гипоталамо-гипофизарную систему. Стимуляция овуляции кломифеном начинается с 5-го по 9-й день менструального цикла, по 50 мг в день. При таком режиме повышение уровня гонадртропинов, индуцированное кломифеном, происходит в то время, когда уже завершился выбор доминантного фолликула. Более раннее назначение кломифена может стимулировать развитие множества фолликулов и увеличивает риск многоплодной беременности. При отсутствии овуляции по данным УЗИ и базальной температуры дозу кломифена можно увеличивать в каждом последующем цикле на 50 мг, достигая 200 мг в день. Однако многие клиницисты полагают, что если нет эффекта при назначении 100-150 мг кломифена, то дальнейшее увеличение дозы нецелесообразно. При отсутствии овуляции при максимальной дозе в течение 3 месяцев пациентку можно считать резистентной к кломифену.
Критериями эффективности стимуляции овуляции служат:
При наличии этих показателей рекомендуется введение овуляторной дозы 7500-10000 МЕ человеческого хорионического гонадотропина — чХГ (профази, хорагон, прегнил), после чего овуляция отмечается через 36-48 ч. При лечении кломифеном следует учитывать, что он обладает антиэстрогенными свойствами, уменьшает количество цервикальной слизи («сухая шейка»), что препятствует пенетрации сперматозоидов и тормозит пролиферацию эндометрия и приводит к нарушению имплантации в случае оплодотворения яйцеклетки. С целью устранения этих нежелательных эффектов препарата рекомендуется после окончания приема кломифена принимать натуральные эстрогены в дозе 1-2 мг. или их синтетические аналоги (микрофоллин) с 10-го по 14-й день цикла для повышения проницаемости шеечной слизи и пролиферации эндометрия.
При недостаточности лютеиновой фазы рекомендуется назначить гестагены во вторую фазу цикла с 16-го по 25-й день. При этом предпочтительнее препараты прогестерона (дюфастон, утрожестан).
Частота индукции овуляции при лечении кломифеном составляет примерно 60-65%, наступление беременности — в 32-35% случаев, частота многоплодной беременности, в основном двойней, составляет 5-6%, риск внематочной беременности и самопроизвольных выкидышей не выше, чем в популяции. При отсутствии беременности на фоне овуляторных циклов требуется исключение перитонеальных факторов бесплодия при лапароскопии.
При резистентности к кломифену назначают гонадотропные препараты — прямые стимулятороы овуляции. Используется человеческий менопаузальный гонадотропин (чМГ), приготовленный из мочи женщин постменопаузального возраста. Препараты чМГ содержат ЛГ и ФСГ, по 75 МЕ (пергонал, меногон, менопур и др.). При назначении гонадотропинов пациентка должна быть информирована о риске многоплодной беременности, возможном развитии синдрома гиперстимуляции яичников, а также о высокой стоимости лечения. Лечение должно проводится только после исключения патологии матки и труб, а также мужского фактора бесплодия. В процессе лечения обязательным является трансвагинальный УЗ-мониторинг фолликулогенеза и состояния эндометрия. Овуляция инициируется путем однократного введения чХГ в дозе 7500-10000 МЕ, когда имеется хотя бы один фолликул диаметром 17 мм. При выявлении более 2 фолликулов диаметром более 16 мм. или 4 фолликулов диаметром более 14 мм. введение чХГ нежелательно из-за риска наступления многоплодной беременности.
При стимуляции овуляции гонадотропинами частота наступления беременности повышается до 60%, риск многоплодной беременности составляет 10-25%, внематочной — 2,5-6%, самопроизвольные выкидыши в циклах, закончившихся беременностью, достигают 12-30%, синдром гиперстимуляции яичников наблюдается в 5-6% случаев.
Хирургическое лечение СПКЯ
Несмотря на достаточно высокий эффект при стимуляции овуляции и наступлении беременности, большинство врачей отмечают рецидив клинической симптоматики СПКЯ примерно через 5 лет. Поэтому послебеременности и родов необходима профилактика рецидива СПКЯ, что важно, учитывая риск развития гиперпластических процессов эндометрия. С этой целью наиболее целесообразно назначение КОК, предпочтительнее монофазных (марвелон, фемоден, диане, мерсилон и др.). При плохой переносимости КОК, что бывает при избыточной массе тела, можно рекомендовать гестагены во вторую фазу цикла: дюфастон в дозе 20 мг. с 16-го по 25-й день цикла.
Женщинам, не планирующим беременность, после первого этапа стимуляции овуляции кломифеном, направленного на выявление резервных возможностей репродуктивной системы, также рекомендуется назначение КОК или гестагенов для регуляции цикла, уменьшения гирсутизма и профилактики гиперпластических процессов.
Физиотерапия и фитнесс для лечения СПКЯ
Физиотерапевтические процедуры также показаны при СПКЯ. Применяют гальванофорез лидазы для активации ферментативной системы яичников. Электроды устанавливают в надлобковой области. Курс лечения-15 дней ежедневно.
Лечение поликистоза яичников длительное, требующее тщательного наблюдения у гинеколога-эндокринолога. Всем женщинам с СПКЯ рекомендуется, по возможности, как можно раньше беременеть и рожать, поскольку симптомы заболевания, увы, с возрастом довольно часто прогрессируют.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.