макрофаги и фагоциты чем отличаются
Фагоциты – это специальные клетки, которые находятся в крови и тканях практически по всему организму. Они отвечают за его защиту от вредоносных агентов разной природы, которые обошли защитные барьеры и попали внутрь тела.
Назначение фагоцитов в том, чтобы определять, захватывать и пожирать чужеродные твердые частицы: бактерии, вредные вещества, инородные тела и т.д. Так как и сами «вредители», и ткани, в которых вынуждены работать клетки-защитники, очень разные, то и фагоциты делятся на несколько видов.
Особую ценность представляют так называемые профессиональные фагоциты, которые не только эффективно уничтожают, но еще и «запоминают врага в лицо», чтобы в дальнейшем при встрече с ним сразу же его нейтрализовать. Итак, какие же именно клетки фагоциты присутствуют у человека в организме?
Моноциты:
Макрофаги:
Моноциты и макрофаги объединяют под названием «система мононуклеарных фагоцитов». Макрофаги, в отличие от моноцитов, в обычных условиях не способны к быстрым перемещениям. Но если где-то в организме возникает очаг воспаления, они мигрируют туда и из безмолвных стражников превращаются в яростных убийц, уничтожающих бактерии, а также атакующих органические и неорганические инородные тела.
Нейтрофилы:
Дендритные клетки:
Возможно, некоторые читатели впервые видят такое название и раньше даже не подозревали, что такие клетки вообще существуют. Тем не менее, они есть, и в большом количестве располагаются в тканях человека. Как правило, они находятся близко к внешней среде и полостям органов: под слизистой желудка, в альвеолярной ткани легких, в слизистой носа и т.д. Дендритными их назвали потому, что их многочисленные длинные отростки придают им ветвящуюся структуру и делают похожими на деревья (dendron – дерево).
В перечисленных тканях клетки созревают, после чего направляются к очагам скоплений лимфоидной ткани, взаимодействуют с лимфоцитами и макрофагами и увеличивают их активность.
Лаброциты:
Лаброциты еще называют тучными клетками. Они, как и дендритные, определенным образом взаимодействуют с другими элементами иммунитета и повышают эффективность их работы. Сами они также обладают фагоцитарной активностью, особенно охотно включая в свой «рацион» некоторые виды бактерий (грамотрицательные бактерии). Но их главная особенность заключается в том, что они запускают реакцию воспаления, без которой ни макрофаги, ни нейтрофилы, никакие другие фагоциты не смогут начать свои действия против агрессоров.
Реакция воспаления – это сигнал тревоги, «ордер на арест», команда «фас» для всех существующих фагоцитов. Именно поэтому немногочисленные тучные клетки играют исключительную роль в работе всего иммунитета.
Непрофессиональные фагоциты:
К этой группе клеток относятся еще несколько разновидностей фагоцитов, которые не обладают направленным действием против конкретных «врагов», так как не умеют презентировать антигены. У них есть фагоцитарная активность, но она выражена меньше, чем у других клеток, описанных выше. Примерами могут служить клетки кожи, некоторые элементы соединительной ткани и т.д. Существуют животные, у которых к фагоцитозу способна сетчатка глаза и даже яйцеклетки!
Итак, в тканях и крови организма присутствует большое 
Зная о хрупкости этой системы, важно не допустить появления в ней дисбаланса. Для этого необходимо следить за своим общим состоянием, вести правильный образ жизни, обязательно сразу и до конца лечить все возникшие заболевания, а также принимать специальные средства для поддержки иммунитета.
Препарат Трансфер Фактор в этом случае оптимален: он обладает уникальным иммуномодулирующим действием. Содержащиеся в нем информационные молекулы несут в себе огромный багаж иммунологической памяти, накопленной многими поколениями живых существ. Ценность этой информации увеличивает тот факт, что она представлена на «языке», знакомом нашему иммунитету, так как добыта в процессе деятельности таких же клеток-фагоцитов.
Информационные молекулы передают имеющиеся данные клеткам иммунитета, те распространяют ее между собой. Это становится толчком к нормализации работы органов и естественному самооздоровлению организма, что является залогом укрепления и сохранения здоровья в целом.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
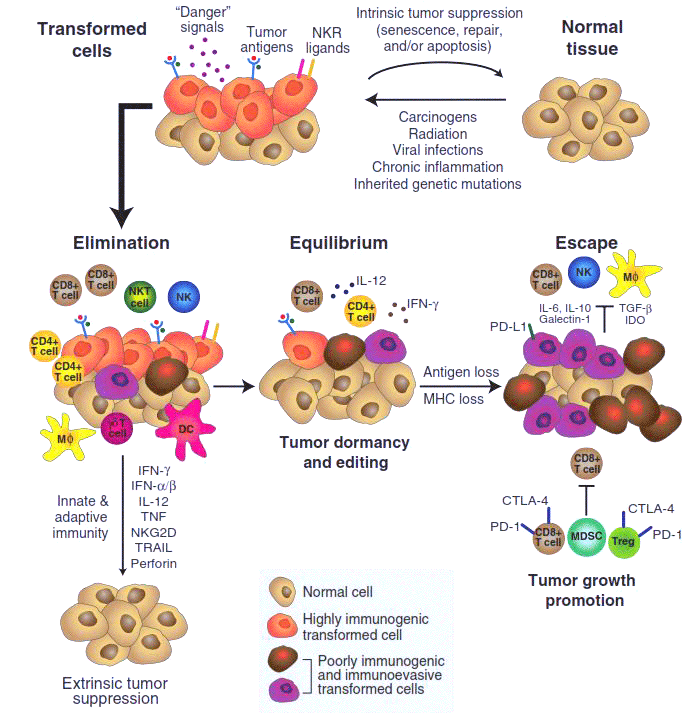
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
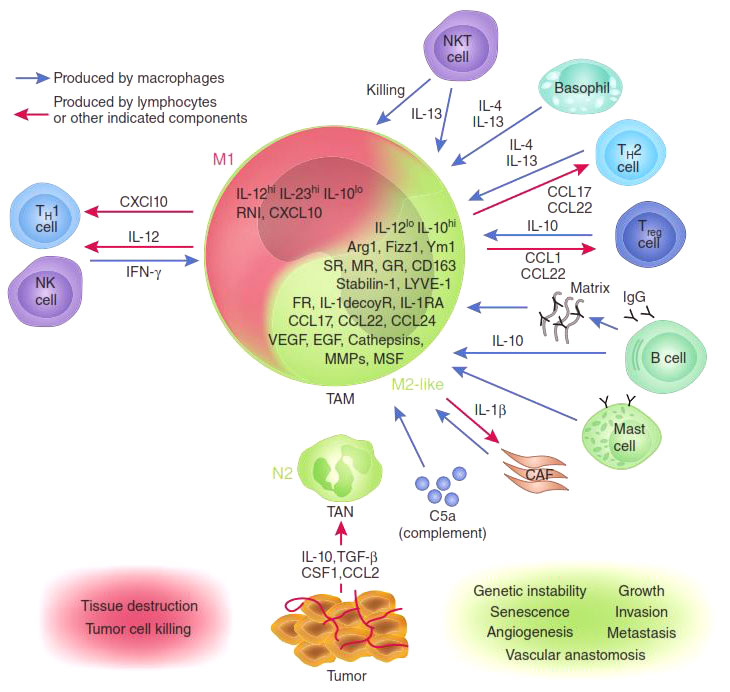
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
Макрофаг многоликий и вездесущий
Сто тридцать лет назад замечательный русский исследователь И.И. Мечников в опытах на личинках морских звезд из Мессинского пролива сделал удивительное открытие, круто изменившее не только жизнь самого будущего Нобелевского лауреата, но и перевернувшее тогдашние представления об иммунной системе.
Втыкая в прозрачное тело личинки розовый шип, ученый обнаружил, что занозу окружают и атакуют крупные амебоидные клетки. И если чужеродное тело было небольшим, эти блуждающие клетки, которые Мечников назвал фагоцитами (от греч. пожиратель), могли полностью поглотить пришельца.
Долгие годы считалось, что фагоциты выполняют в организме функции «войск быстрого реагирования». Однако исследования последних лет показали, что благодаря своей огромной функциональной пластичности эти клетки еще и «определяют погоду» многих метаболических, иммунологических и воспалительных процессов, как в норме, так и при патологии. Это делает фагоциты перспективной мишенью при разработке стратегии лечения ряда тяжелых заболеваний человека
Подвижные клетки иммунной системы – фагоциты или макрофаги, присутствуют практически во всех тканях организма. Они осуществляют активный захват, переваривание и обезвреживание чужеродных микроорганизмов (вирусов, бактерий, одноклеточных, паразитов), а также утилизацию биологического «мусора», такого как «невостребованные» и погибшие клетки (например, «стареющие» эритроциты).
В зависимости от своего микроокружения тканевые макрофаги могут выполнять и различные специализированные функции. Например, макрофаги костной ткани – остеокласты, также занимаются выведением из кости гидроксиапатита кальция. При недостаточности этой функции развивается мраморная болезнь – кость становится чрезмерно уплотненной и при этом хрупкой.
Но самым, пожалуй, удивительным свойством макрофагов оказалась их огромная пластичность, т. е. способность изменять свою транскрипционную программу («включение» тех или иных генов) и свой облик (фенотип). Следствием этой особенности является высокая разнородность клеточной популяции макрофагов, среди которых присутствуют не только «агрессивные» клетки, встающие на защиту организма-хозяина; но и клетки с «полярной» функцией, отвечающие за процессы «мирного» восстановления поврежденных тканей.
Липидные «антенны»
Своей потенциальной «многоликостью» макрофаг обязан необычной организации генетического материала – так называемому открытому хроматину. Этот не до конца изученный вариант структуры клеточного генома обеспечивает быстрое изменение уровня экспрессии (активности) генов в ответ на различные стимулы.
Выполнение макрофагом той или иной функции зависит от характера получаемых им стимулов. Если стимул будет распознан как «чужой», то происходит активация тех генов (и соответственно функций) макрофага, которые направлены на уничтожение «пришельца». Однако макрофаг могут активировать и сигнальные молекулы самого организма, которые побуждают эту иммунную клетку участвовать в организации и регуляции обмена веществ. Так, в условиях «мирного времени», т. е. при отсутствии патогена и обусловленного им воспалительного процесса, макрофаги участвуют в регуляции экспрессии генов, отвечающих за метаболизм липидов и глюкозы, дифференцировку клеток жировой ткани.
Интеграция между взаимоисключающими «мирным» и «военным» направлениями работы макрофагов осуществляется путем изменения активности рецепторов клеточного ядра, представляющих собой особую группу регуляторных белков.
Среди этих ядерных рецепторов следует особо выделить так называемые липидные сенсоры, т. е. белки, способные взаимодействовать с липидами (например, окисленными жирными кислотами или производными холестерина) (Смирнов, 2009). Нарушение работы этих чувствительных к липидам регуляторных белков в макрофагах может быть причиной системных обменных нарушений. Например, дефицит в макрофагах одного из этих ядерных рецепторов, обозначаемых как PPAR-гамма, приводит к развитию диабета 2 типа и дисбалансу липидного и углеводного обмена во всем организме.
Клеточные метаморфозы
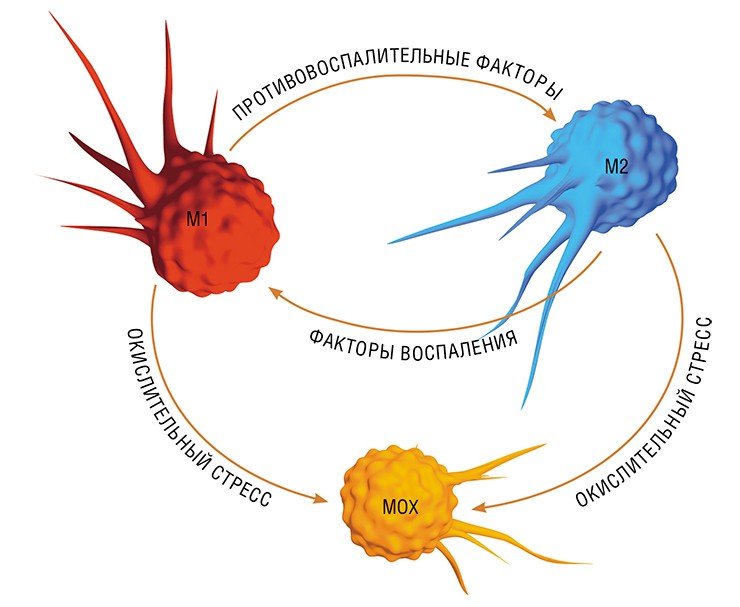
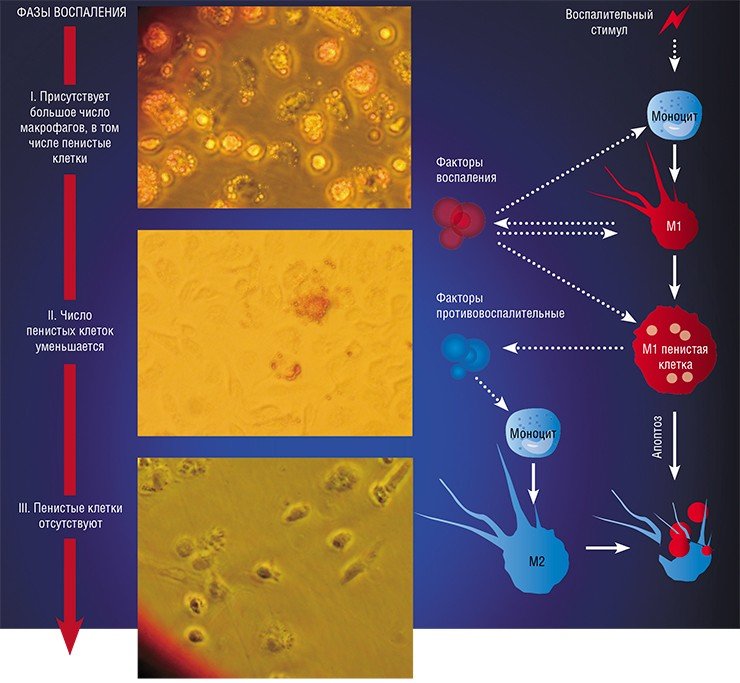
В разнородном сообществе макрофагов на основе базовых характеристик, определяющих их принципиальные функции, выделяют три основных клеточных субпопуляции: макрофаги М1, М2 и Мox, которые участвуют, соответственно, в процессах воспаления, восстановления поврежденных тканей, а также защите организма от окислительного стресса.
«Классический» макрофаг М1 формируется из клетки-предшественника (моноцита) под действием каскада внутриклеточных сигналов, запускающихся после распознавания инфекционного агента с помощью специальных рецепторов, расположенных на поверхности клетки.
Образование «пожирателя» М1 происходит в результате мощной активации генома, сопровождаемой активацией синтеза более чем сотни белков – так называемых факторов воспаления. К ним относятся ферменты, способствующие генерации свободных радикалов кислорода; белки, привлекающие в очаг воспаления другие клетки иммунной системы, а также белки, способные разрушать оболочку бактерий; воспалительные цитокины – вещества, обладающие свойствами активировать иммунные клетки и оказывать токсическое действие на остальное клеточное окружение. В клетке активируется фагоцитоз и макрофаг начинает активно разрушать и переваривать все, что встретится на его пути (Шварц, Свистельник, 2012). Так появляется очаг воспаления.
Однако уже на начальных этапах воспалительного процесса макрофаг М1 начинает активно секретировать и противовоспалительные субстанции – низкомолекулярные липидные молекулы. Эти сигналы «второго эшелона» начинают активировать вышеупомянутые липидные сенсоры в новых «рекрутах»-моноцитах, прибывающих в очаг воспаления. Внутри клетки запускается цепь событий, в результате которых активирующий сигнал поступает на определенные регуляторные участки ДНК, усиливая экспрессию генов, отвечающих за гармонизацию обмена веществ и одновременно подавляя активность «провоспалительных» (т. е. провоцирующих воспаление) генов (Душкин, 2012).
Так в результате альтернативной активации образуются макрофаги М2, которые завершают воспалительный процесс и способствуют тканевому восстановлению. Популяцию М2 макрофагов можно, в свою очередь, разделить на группы в зависимости от их специализации: уборщики мертвых клеток; клетки, участвующие в реакции приобретенного иммунитета, а также макрофаги, секретирующие факторы, которые способствуют замещению погибших тканей соединительной тканью.
Еще одна группа макрофагов – Мох, формируется в условиях так называемого окислительного стресса, когда в тканях возрастает опасность повреждения их свободными радикалами. Например, Мох составляют около трети всех макрофагов атеросклеротической бляшки. Эти иммунные клетки не только сами устойчивы к повреждающим факторам, но и участвуют в антиоксидантной защите организма(Gui et al., 2012).
Пенистый камикадзе
Одной из самых интригующих метаморфоз макрофага является его превращение в так называемую пенистую клетку. Такие клетки были обнаружены в атеросклеротических бляшках, а свое название получили из-за специфического внешнего вида: под микроскопом они напоминали мыльную пену. По сути, пенистая клетка – это тот же макрофаг М1, но переполненный жировыми включениями, преимущественно состоящими из водонерастворимых соединений холестерина и жирных кислот.
Была высказана гипотеза, ставшая общепринятой, что пенистые клетки образуются в стенке атеросклеротических сосудов в результате неконтролируемого поглощения макрофагами липопротеинов низкой плотности, переносящих «плохой» холестерин. Однако впоследствии было обнаружено, что накопление липидов и драматическое (в десятки раз!) возрастание скорости синтеза ряда липидов в макрофагах можно спровоцировать в эксперименте только лишь одним воспалением, без всякого участия липопротеинов низкой плотности (Душкин, 2012).
Это предположение подтвердилось клиническими наблюдениями: оказалось, что превращение макрофагов в пенистую клетку происходит при разнообразных заболеваниях воспалительной природы: в суставах – при ревматоидном артрите, в жировой ткани – при диабете, в почках – при острой и хронической недостаточности, в ткани мозга – при энцефалитах. Однако понадобилось около двадцати лет исследований, чтобы понять, как и зачем макрофаг при воспалении превращается в клетку, нафаршированную липидами.
Оказалось, что активация провоспалительных сигнальных путей в М1 макрофагах приводит к «выключению» тех самых липидных сенсоров, которые в нормальных условиях контролируют и нормализуют липидный обмен (Душкин, 2012). При их «выключении» клетка и начинает накапливать липиды. При этом образующиеся липидные включения представляют собой вовсе не пассивные жировые резервуары: входящие в их состав липиды обладают способностью усиливать воспалительные сигнальные каскады. Главная цель всех этих драматических изменений – любыми средствами активировать и усилить защитную функцию макрофага, направленную на уничтожение «чужих» (Melo, Drorak, 2012).
Однако высокое содержание холестерина и жирных кислот дорого обходится пенистой клетке – они стимулируют ее гибель путем апоптоза, запрограммированной клеточной смерти. На внешней поверхности мембраны таких «обреченных» клеток обнаруживается фосфолипид фосфатидилсерин, в норме расположенный внутри клетки: появление его снаружи является своеобразным «похоронным звоном». Это сигнал «съешь меня», который воспринимают М2 макрофаги. Поглощая апоптозные пенистые клетки, они начинают активно секретировать медиаторы заключительной, восстановительной стадии воспаления.
Фармакологическая мишень
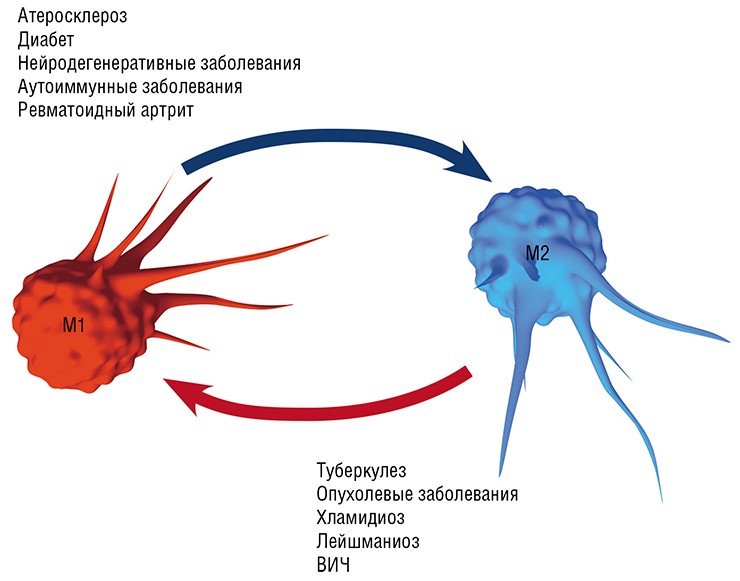
Воспаление как типовой патологический процесс и ключевое участие в нем макрофагов является, в той или иной мере, важной составляющей в первую очередь инфекционных заболеваний, вызванных различными патологическими агентами, от простейших и бактерий до вирусов: хламидиальные инфекции, туберкулез, лейшманиоз, трипаносомоз и др. Вместе с тем макрофаги, как уже упоминалось выше, играют важную, если не ведущую, роль в развитии так называемых метаболических заболеваний: атеросклероза (главного виновника сердечно-сосудистых заболеваний), диабета, нейродегенеративных заболеваний мозга (болезнь Альцгеймера и Паркинсона, последствия инсультов и черепно-мозговых травм), ревматоидного артрита, а также онкологических заболеваний.
Разработать стратегию управления этими клетками при различных заболеваниях позволили современные знания о роли липидных сенсоров в формировании различных фенотипов макрофага.
Так, оказалось, что в процессе эволюции хламидии и туберкулезные палочки научились использовать липидные сенсоры макрофагов, чтобы стимулировать не опасную для них альтернативную (в М2) активацию макрофагов. Благодаря этому поглощенная макрофагом туберкулезная бактерия может, купаясь как сыр в масле в липидных включениях, спокойно дожидаться своего освобождения, а после гибели макрофага размножаться, используя содержимое погибших клеток в качестве пищи (Melo, Drorak, 2012).
Если в этом случае использовать синтетические активаторы липидных сенсоров, которые препятствуют образованию жировых включений и, соответственно, предотвращают «пенистую» трансформацию макрофага, то можно подавить рост и понизить жизнеспособность инфекционных патогенов. По крайней мере в экспериментах на животных уже удалось в разы снизить обсемененность легких мышей туберкулезными бациллами, используя стимулятор одного из липидных сенсоров или ингибитор синтеза жирных кислот (Lugo-Villarino et al., 2012).
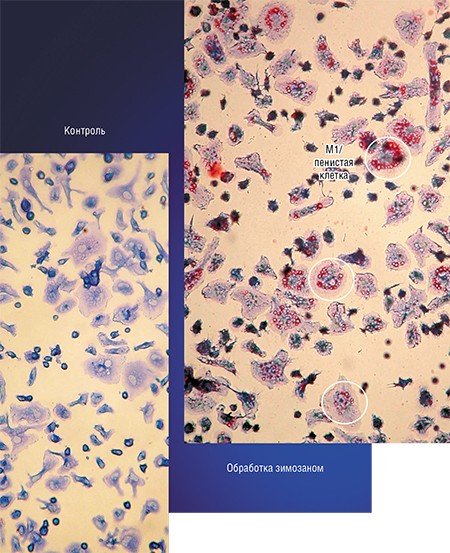
Формированию таких нестабильных атеросклеротических бляшек и способствует макрофаг М1/пенистая клетка, который продуцирует ферменты, растворяющие коллагеновое покрытие бляшки. В этом случае наиболее эффективная стратегия лечения – превращение нестабильной бляшки в стабильную, богатую коллагеном, для чего требуется трансформировать «агрессивный» макрофаг М1 в «умиротворенный» М2.
Экспериментальные данные свидетельствуют, что подобной модификации макрофага можно добиться, подавляя в нем продукцию провоспалительных факторов. Такими свойствами обладает ряд синтетических активаторов липидных сенсоров, а также природные вещества, например, куркумин – биофлавоноид, входящий в состав корня куркумы, хорошо известной индийской пряности.
Нужно добавить, что такая трансформация макрофагов актуальна при ожирении и диабете 2 типа (большая часть макрофагов жировой ткани имеет М1 фенотип), а также при лечении нейродегенеративных заболеваний мозга. В последнем случае в мозговых тканях происходит «классическая» активация макрофагов, что приводит к повреждению нейронов и накоплению токсичных веществ. Превращение М1-агрессоров в мирных дворников М2 и Mox, уничтожающих биологический «мусор», может в ближайшее время стать ведущей стратегией лечения этих заболеваний (Walace, 2012).
С воспалением неразрывно связано и раковое перерождение клеток: например, имеются все основания считать, что 90 % опухолей в печени человека возникает как следствие перенесенных инфекционных и токсических гепатитов. Поэтому с целью профилактики раковых заболеваний необходимо контролировать популяцию М1 макрофагов.
Однако не все так просто. Так, в уже сформированной опухоли макрофаги преимущественно приобретают признаки статуса М2, который содействует выживанию, размножению и распространению самих раковых клеток. Более того, такие макрофаги начинают подавлять противораковый иммунный ответ лимфоцитов. Поэтому для лечения уже образовавшихся опухолей разрабатывается другая стратегия, основанная на стимулировании у макрофагов признаков классической М1-активации (Solinas et al., 2009).
Примером такого подхода служит технология, разработанная в новосибирском Институте клинической иммунологии СО РАМН, при которой макрофаги, полученные из крови онкобольных, культивируют в присутствии стимулятора зимозана, который накапливается в клетках. Затем макрофаги вводят в опухоль, где зимозан освобождается и начинает стимулировать классическую активацию «опухолевых» макрофагов.
Сегодня становится все более очевидно, что соединения, вызывающие метаморфозы макрофагов, оказывают выраженное атеропротективное, антидиабетическое, нейропротективное действие, а также защищают ткани при аутоиммунных заболеваниях и ревматоидном артрите. Однако такие препараты, имеющиеся на сегодня в арсенале практикующего врача, – фибраты и производные тиазолидона, хотя и снижают смертность при этих тяжелых заболеваниях, но при этом имеют выраженные тяжелые побочные действия.
Эти обстоятельства стимулируют химиков и фармакологов к созданию безопасных и эффективных аналогов. За рубежом – в США, Китае, Швейцарии и Израиле уже проводятся дорогостоящие клинические испытания подобных соединений синтетического и природного происхождения. Несмотря на финансовые трудности, российские, в том числе и новосибирские, исследователи также вносят свой посильный вклад в решение этой проблемы.
Так, на кафедре химии Новосибирского государственного университета было получено безопасное соединение TS-13, стимулирующее образование Мox фагоцитов, которое обладает выраженным противовоспалительным эффектом и оказывает нейропротективное действие в экспериментальной модели болезни Паркинсона (Дюбченко и др., 2006; Зенков и др., 2009).
В Новосибирском институте органической химии им. Н. Н. Ворожцова СО РАН созданы безопасные антидиабетические и противоатеросклеротические препараты, действующие сразу на несколько факторов, благодаря которым «агрессивный» макрофаг М1 превращается в «мирный» М2 (Dikalov et al., 2011). Большой интерес вызывают и растительные препараты, получаемые из винограда, черники и других растений с помощью механохимической технологии, разработанной в Институте химии твердого тела и механохимии СО РАН (Dushkin, 2010).
С помощью финансовой поддержки государства можно в самое ближайшее время создать отечественные средства для фармакологических и генетических манипуляций с макрофагами, благодаря которым появится реальная возможность превращать эти иммунные клетки из агрессивных врагов в друзей, помогающих организму сохранить или вернуть здоровье.
Душкин М. И. Макрофаг/пенистая клетка как атрибут воспаления: механизмы образования и функциональная роль // Биохимия, 2012. T. 77. C. 419—432.
Смирнов А. Н. Липидная сигнализация в контексте атерогенеза // Биохимия. 2010. Т. 75. С. 899—919.
Шварц Я. Ш., Свистельник А. В.Функциональные фенотипы макрофагов и концепция М1-М2-поляризации. Ч. 1 Провоспалительный фенотип. // Биохимия. 2012. Т. 77. С. 312—329.