макрофагальная инфильтрация что это
Макрофагальная инфильтрация что это
а) Воспаление. При повреждении ткани независимо от его причины (бактерии, травма, химические агенты, тепло или любое другое явление) выделяется множество веществ, вызывающих существенные вторичные изменения в окружающих неповрежденных тканях. Весь комплекс этих тканевых изменений называют воспалением.
(1) расширением местных кровеносных сосудов с последующим избыточным местным кровотоком;
(2) увеличением проницаемости капилляров, что способствует утечке большого количества жидкости в интерстициальное пространство;
(3) часто — свертыванием жидкости в интерстициальном пространстве в связи с избытком фибриногена и других белков, вытекающих из капилляров;
(4) миграцией большого числа гранулоцитов и моноцитов в ткани;
(5) отеком тканевых клеток.
К тканевым продуктам, вызывающим эти реакции, относятся гистамин, брадикинин, серотонин, простагландины, несколько разных продуктов реакции системы комплемента, продукты реакции свертывающей системы крови и множество веществ, называемых лимфокинами, которые выделяются активированными Т-клетками (частью иммунной системы). Некоторые из этих веществ мощно активируют макрофагальную систему, и в течение нескольких часов макрофаги начинают уничтожать поврежденные ткани. Но иногда макрофаги повреждают еще живые тканевые клетки.
б) «Ограждающий» эффект воспаления. Одним из первых результатов воспаления является «ограждение» области повреждения от остальных тканей. Тканевые пространства и лимфатические сосуды в воспаленной области блокируются сгустками фибрина, поэтому через небольшой промежуток времени жидкость с трудом протекает через интерстиций. Этот процесс отгораживания задерживает распространение бактерий или токсических продуктов.
Интенсивность воспалительного процесса обычно пропорциональна степени повреждения ткани. Например, когда стафилококки проникают в ткани, они выделяют смертельно опасные клеточные токсины. В результате воспаление развивается быстро, гораздо быстрее, чем сами стафилококки могут размножиться и распространиться. Следовательно, для локальной стафилококковой инфекции характерно быстрое отгораживание, предохраняющее от распространения ее по телу.
Стрептококки, напротив, не вызывают такого интенсивного локального разрушения тканей. Следовательно, процесс отгораживания развивается медленно, на протяжении многих часов, в течение которых стрептококки успевают размножиться и мигрировать. В результате стрептококки часто проявляют гораздо более выраженную тенденцию к распространению в организме и развитию смертельных состояний, чем стафилококки, несмотря на то, что стафилококки гораздо более губительны для тканей.
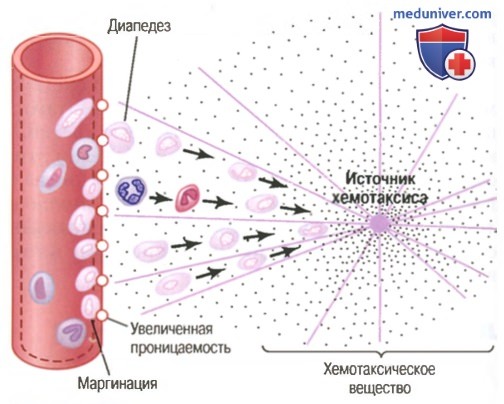
Реакции макрофагов и нейтрофилов во время воспаления
Затем многие из ранее неподвижных макрофагов отделяются от мест их прикрепления и становятся мобильными, формируя первую «линию обороны» против инфекции в течение примерно первого часа. Количество этих рано мобилизуемых макрофагов часто незначительно, но они спасают жизнь.
б) Вторжение нейтрофилов в воспаленную область является второй «линией обороны». В течение примерно первого часа после начала воспаления большое число нейтрофилов начинает внедряться в воспаленную область из крови. Этот процесс вызывается продуктами воспаленных тканей, которые инициируют следующие реакции:
(1) изменяют внутреннюю поверхность эндотелия капилляров, способствуя прилипанию нейтрофилов к стенкам капилляров в воспаленной области. Этот эффект, показанный на рисунке выше, называют маргинацией (или краевым стоянием лейкоцитов),
(2) ведут к разрыхлению сцеплений между эндотелиальными клетками капилляров и небольших венул, обеспечивая появление достаточно больших отверстий для прохождения нейтрофилов путем диапедеза непосредственно из крови в тканевые пространства;
(3) другие продукты воспаления вызывают хемотаксис нейтрофилов в направлении поврежденных тканей, как объяснялось ранее.
Таким образом, в течение нескольких часов после начала повреждения тканей область обильно заполняется нейтрофилами. Поскольку нейтрофилы крови — уже зрелые клетки, они готовы немедленно начать свои очистительные функции для уничтожения бактерий и удаления инородного материала.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гиперпластические процессы эндометрия: особенности пролиферативной активности при сочетании с хроническим эндометритом.
Акушерство, гинекология и репродукция. 2011; N3: c.10-15
Проведено комплексное патоморфологическое и иммуногистохимическое исследование соскобов эндометрия. При гиперпластическим процессе эндометрия и хроническом эндометрите отмечена высокая пролиферативная активность стромы желез (Кi-67), высокая экспрессия ТФР-β и СЭФР, что указывает на активно идущие процессы неоангиогенеза и нарушения во внеклеточном матриксе. Воспаление потенцирует пролиферативную активность эпителия и стромы гиперплазированного эндометрия, а значит, создает благоприятные условия для атипической трансформации клеток.
Ключевые слова: гиперпластические процессы эндометрия, хронический эндометрит, маркеры пролиферации, ТФР бета, СЭФР
ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздравсоцразвития России
Городская клиническая больница № 14 им. В.Г. Короленко департамента здравоохранения г. Москвы
Гиперпластические процессы эндометрия (ГПЭ), которые рассматриваются как основа для формирования рака эндометрия, продолжают оставаться актуальной проблемой в современной гинекологии [3,4,5].
Развитию ГПЭ способствуют множество разнообразных факторов и причин, среди которых наиболее часто выделяют гиперэстрогению, наличие эстроген-секретирующих опухолей яичников и ожирение [1,3].
Многие исследователи высказывают мнение о важной роли хронического воспаления эндометрия в развитии ГПЭ. Хронический эндометрит чаще является следствием перенесенного ранее острого воспаления. Факторами риска развития хронического эндометрита являются инфекционные процессы влагалища и шейки матки, использование внутриматочных контрацептивов, инвазивные внутриматочные вмешательства и др. [2].
Хронический эндометрит приводит не только к выраженным структурным и функциональным изменениям в ткани эндометрия, но и вызывает нарушение процессов пролиферации и секреторной трансформации эндометрия [2,4,6].
В этой связи, именно хронический воспалительный процесс может создавать оптимальные предпосылки не только для формирования пролиферативных процессов в эндометрии, но и для дальнейшей их атипической трансформации.
Целью настоящего исследования является определение частоты сочетания ГПЭ и хронического эндометрита и изучение пролиферативной активности клеток эндометрия при данных патологических состояниях на основании данных клинического, гистологического и иммуноморфологического методов исследования.
Материалы и методы исследования
В группу исследования вошли 320 пациенток, у которых по данным гистологического исследования ткани эндометрия, полученной при раздельном диагностическом выскабливании матки, был диагностирован гиперпластический процесс эндометрия.
Показаниями для госпитализации женщин в гинекологическое отделение ГКБ №14 явились: наличие эхографических признаков гиперплазии эндометрия (20,6%) и/или нарушение менструального цикла различного характера (79,4%).
Критериями включения женщин в исследование послужили: перименопаузальный период (средний возраст 48±2,9 г.), наличие гиперпластического процесса эндометрия без атипии, отсутствие онкологических заболеваний в анамнезе.
На основании результатов гистологического исследования материала из цервикального канала и эндометрия были отобраны пациентки и сформированы группы.
I группа – 204 женщины с простой гиперплазией эндометрия без атипии, II группа – 50 пациенток со сложной гиперплазией эндометрия без атипии, III группа – 66 женщин, у которых, по данным гистологического исследования, помимо гиперплазии эндометрия был диагностирован хронический эндометрит.
Комплексное обследование женщин включало сбор анамнеза, оценку соматического статуса, менструальной и репродуктивной функции, а также гистологические заключения о состоянии эндометрия (при наличии указаний в анамнезе о перенесенных ранее выскабливаниях матки).
Группы были сопоставимы по возрасту и паритету и тщательно подобраны с целью исключения влияния случайных факторов.
Морфологическое исследование проводили в Московском городском центре патологоанатомических исследований при Городской клинической больнице № 14 им. В.Г. Короленко департамента здравоохранения г. Москвы и кафедре патологической анатомии ГОУ ВПО «Московский государственный медико-стоматологический университет» Минздравсоцразвития России (руководитель центра и зав. кафедрой – проф. О.В. Зайратьянц).
Гистологический метод: полученный материал фиксировали в 10% нейтральном забуференном формалине и по общепринятой методике заливали в парафиновые блоки. Изготовленные из них на микротоме Leica (Leica, Германия) гистологические срезы, толщиной 4-5 мкм (не менее 2-х срезов с каждого блока), окрашивали гематоксилином и эозином. Препараты изучали и фотографировали, используя микроскоп Leica DM LB (Leica, Германия) с цифровой фотокамерой Olympus (Olympus, Япония).
Для иммуноморфологического исследования использовали иммунопероксидазный метод с применением 5 первичных специфических моноклональных антител.
Гистологические срезы толщиной 4-5 мкм, изготовленные из парафиновых блоков с помощью микротома Leica (Leica, Германия) помещали на покрытые специальным адгезивом (APES-ацетон) предметные стекла. Эндогенную пероксидазу в депарафинированных срезах блокировали 3% перекисью водорода. Демаскировку антигенов производили по стандартной схеме, в микроволновой печи в течение 20 минут при 600В в 0,1 М растворе цитратного буфера (рH 6,0).
В качестве первичных специфических использовали 5 моноклональных антител производства компаний Dako (Дания) и Lab Vision (в составе Thermo Fisher Scientific, США) к: маркеру пролиферирующих клеток, ядерному белку Ki-67; сосудисто-эндотелиальному фактору роста (СЭФР, клон G153-694); трансформирующему фактору роста – β1 (ТФР-β1); иммуноглобулинам М (IgM); иммуноглобулинам G (IgG).
После инкубации гистологических срезов с первичными антителами (рабочее разведение антисывороток – 1:50-100, время инкубации – 45-60 мин при температуре 37ºС), их обрабатывали вторичными биотилированными антикроличьими иммуноглобулинами.
Для последующей визуализации результата реакции связывания антигена с антителом использовали систему детекции «Ultra Vision LP Value HRP Polymer» производства Lab Vision (в составе Thermo Fisher Scientific, США). Применяли фермент (пероксидазу хрена) в присутствии субстрата (перекиси водорода) и специального реактива (3,3– диаминобензидин).
Конечный продукт реакции представляет собой мелкие коричневатые гранулы в участках локализации антигена. Для таких антигенов, как Ki-67 это – ядра клеток, для других – цитоплазма и/или клеточные мембраны клеток, в определенной мере – экстрацеллюлярный матрикс.
Проводили общепринятые отрицательные и положительные контрольные процедуры на используемые реагенты и ткани при обработке параллельных срезов.
После проведения иммунопероксидазной реакции гистологические препараты докрашивали гематоксилином, изучали и фотографировали, используя световой микроскоп Leica DM-LB (Leica, Германия) с цифровой фотокамерой Olympus (Olympus, Япония).
Результаты иммуногистохимических реакций оценивали с помощью полуколичественного морфометрического метода [5] и вычисляли коэффициенты экспрессии изучаемых антигенов.
Коэффициент экспрессии рассчитывали для каждого наблюдения по формуле: К = сумма (Б х П), деленная на 100, где Б — интенсивность окраски в баллах, а П — процент окрашенных клеток при каждом значении Б.
Результаты исследования и обсуждение
Возраст женщин, которые вошли в исследование, был в пределах от 45 до 55 лет и составил в среднем 48,2±2,9 лет.
Соматически пациентки отобранных групп статистически не имели отличий.
Анализируя гинекологическую заболеваемость, мы отметили, что у всех обследуемых пациенток в анамнезе имелись различные гинекологические заболевания. Наиболее распространенной гинекологической патологией были: доброкачественные процессы шейки матки, воспалительные заболевания нижних отделов половой системы (урогенитальная инфекция, вагинальный кандидоз, бактериальный вагиноз), хронический сальпингоофорит. У 27,5% женщин отмечено сочетание двух и более гинекологических заболеваний.
Характеристика гинекологических заболеваний у обследуемых женщин представлена в таблице 1.
Макрофагальная инфильтрация что это
Опухолевые клетки отличаются от нормальных нарушениями прочной сопряженности между процессами роста и дифференцировки [9]. Увеличение темпа воспроизводства озлокачествленных клеток обеспечивается не столько через укорочение митотического цикла, сколько за счет возрастания количества тех элементов, которые вместо достижения терминальной степени дифференцировки остаются во фракции роста [6, 11, 13]. В качестве еще одного механизма немалую роль играет «карикатурная» сигнальная связь, то есть нарушенная интеграция между малигнизированными клетками, проходящими через этапы дифференцировки, и микроокружением [2, 4]. Достигнут значительный прогресс в области изучения морфофункциональных особенностей слизистой оболочки желудка при предраке и раке, отчасти связанный с развитием высокочувствительных способов выявления в гистологических срезах отдельных тканевых и клеточных компонентов [1, 3]. Однако многие аспекты структурно-метаболической перестройки слизистой оболочки желудка при ее малигнизации остаются предметом дискуссий, и поиск изменений, предшествующих возникновению опухоли, по-прежнему актуален [5, 10].
Материал и методы исследования
Срезы окрашивали гематоксилином и эозином в комбинации с реакцией Перлса, по ван Гизону с окраской эластических волокон резорцин-фуксином Вейгерта, ставили ШИК-реакцию. Полутонкие срезы окрашивали реактивом Шиффа и азуром II. Исследования проводили в универсальном микроскопе Leica DM 4000B (Германия). Ультратонкие срезы, контрастированные уранилацетатом и цитратом свинца, исследовали в электронном микроскопе JEM 1010 при ускоряющем напряжении 80 кВт.
Результаты исследования и их обсуждение
Светооптическое исследование первичных опухолей пациентов 1-й группы выявило превалирование зрелых форм аденокарцином, характеризующихся формированием папиллярных и тубулярных железистых структур, умеренно выраженной тканевой и клеточной атипией, появлением патологических митозов, в разной степени выраженными фиброзными изменениями стромы. В низкодифференцированной аденокарциноме среди обширных скоплений опухолевых клеток или фиброзных полей с трудом обнаруживались мелкие железы, степень анаплазии опухолевых клеток возрастала. Перстневидно-клеточный рак отличался диффузным распределением клеток типичной перстневидной формы и, как правило, отсутствием десмопластической реакции стромы.
Особый интерес представляло изучение состояния слизистой оболочки желудка в отдаленных от опухоли участках. При кишечном типе рака светооптическое исследование фрагментов пилорического отдела желудка во всех наблюдениях выявило наличие распространенной неполной кишечной метаплазии. Обращала на себя внимание атрофия слизистой оболочки, иногда выраженная, с заметным истончением собственной пластинки, дистрофическими изменениями покровно-ямочного эпителия и уменьшением количества желез [7]. Диспластические изменения эпителия от слабой до тяжелой степени (увеличение ядерно-цитоплазматического соотношения, снижение секреции мукоида, псевдомногорядность, повышение митотической активности) обнаружены в большинстве исследованных фрагментов. Характерна многофокусность диспластических изменений, нарастающих по направлению к опухолевому очагу.
В фундальном отделе желудка очаговая кишечная метаплазия эпителиоцитов отмечена у 25% пациентов. Диспластические изменения энтеролизованного и интактного эпителия выявлены в половине наблюдений. Мононуклеарная инфильтрация отличалась слабой интенсивностью и поверхностной локализацией. В целом, патологические изменения в фундальном отделе желудка носили менее выраженный характер по сравнению с пилорическим отделом.
При изучении регионарных лимфатических узлов обращали внимание на наличие, размер и множественность метастазов. У пациентов с аденокарциномами метастазы в лимфатических узлах обнаружили у 37% больных.
Таким образом, светооптическое исследование первичных опухолей желудка пациентов 1-й группы выявило преобладание зрелых форм аденокарцином, характеризующихся формированием капиллярных и тубулярных железистых структур, умеренно выраженной тканевой и клеточной атипией. В большинстве случаев зрелых аденокарцином опухолевый очаг хорошо отграничен от окружающих тканей стенки желудка. Перстневидно-клеточный рак отличался диффузным распределением изолированных округлой формы клеток, содержащих в цитоплазме большое количество слизи. Опухоль характеризовалась инфильтративным ростом и была плохо отграничена от окружающих тканей [8, 12].
Новообразования у пациентов 2-й группы состояли из полиморфных либо мономорфных по составу анапластических клеток, располагающихся в виде тяжей, комплексов, или изолированно друг от друга. Клеточные ядра различались по основным светооптическим характеристикам: форме, размерам, окраске. Наиболее часто в клетках недифференцированного рака желудка встречались крупные гиперхромные угловатой формы ядра, а также небольшие светлые пузырьковые ядра. Цитоплазма была, как правило, скудная и плохо различима. Анализ частоты и выраженности патологических изменений нетрансформированной слизистой оболочки обнаружил их сходство с перифокальными процессами при диффузном типе карцином в первой группе наблюдений, что свидетельствует об определенном гистогенетическом единстве этих вариантов рака желудка. Ведущим патологическим изменением являлась дисплазия генеративных зон желудочного эпителия на фоне атрофически-склеротических процессов. Метастазы в регионарных лимфатических узлах обнаружены у 38% пациентов, что соответствует аналогичному показателю в первой группе.
Таким образом, светооптическое исследование опухолей желудка пациентов 2-й группы выявило наличие недифференцированного рака с солидным или скиррозным характером роста. Опухолевый очаг был плохо отграничен от окружающих тканей стенки желудка, отличался инфильтративным ростом и латеральным распространением опухоли по подслизистому слою.
Смешанные формы (3-я группа) сочетали в одном опухолевом очаге участки аденокарцином с различной степенью дифференцировки (часто с перстневидными клетками) либо разные патогистологические варианты рака желудка. Морфологическая картина отражала направление «дедифференцировки» клеточных популяций от центра к периферии опухоли. Практически во всех исследованных случаях карцинома распространялась в глубь желудочной стенки, инвазируя подслизистый, мышечный, иногда серозный слои, в ряде наблюдений комплексы раковых клеток выявлялись в большом сальнике или брыжейке поперечной ободочной кишки.
В слизистой оболочке вне опухолевого очага у 60% пациентов имелась кишечная метаплазия, ограниченная пилорическим отделом желудка; с такой же частотой встречались атрофия, склероз и густая полиморфно-клеточная инфильтрация. Наличие метастазов в регионарных лимфатических узлах выявлено у 60% оперированных больных этой группы, что значительно превышало данные первых двух анализируемых групп.
Таким образом, светооптический анализ перифокальных процессов в слизистой оболочке при различных патогистологических формах рака желудка показал, что при высоко- и умереннодифференцированных аденокарциномах наиболее типичными изменениями являются распространенная неполная кишечная метаплазия и ассоциированная с этими участками дисплазия на фоне диффузной атрофии эпителия. При низкодифференцированной и перстневидно-клеточной аденокарциномах, а также при недифференцированном раке желудка на первый план выходят атрофические изменения слизистой оболочки и дисплазия генеративных зон эпителия [14].
Электронно-микроскопический анализ аденокарциномы желудка выявил множественные патологические изменения ультраструктуры малигнизированных клеток: большие, неправильной формы ядра с изрезанными контурами и неравномерным распределением крупноглыбчатого гетерохроматина в кариоплазме, увеличенным количеством ядрышек, иногда атипичными митозами.
При перстневидно-клеточном раке желудка преобладали опухолевые клетки с переполненной секреторными гранулами цитоплазмой и эксцентрически расположенным ядром аномальной формы. Слизистая оболочка желудка вне опухолевого очага отличалась мозаичностью ультраструктурной картины. В очагах кишечной метаплазии, кроме типичных покровно-ямочных эпителиоцитов, обнаружены также каемчатые и бокаловидные клетки, цитоплазма которых была переполнена крупными электронно-прозрачными глобулами слизи, а уплощенные ядра оттеснены к базальному полюсу клеток. На апикальной поверхности каемчатых эпителиоцитов выявлялись высокие, нерегулярно расположенные микроворсинки. В цитоплазматическом матриксе большое число митохондрий и развитая гранулярная цитоплазматическая сеть. Отражением атрофических процессов в слизистой оболочке желудка было наличие большого числа эпителиоцитов, почти лишенных микроворсинок, имеющих электронно-плотную цитоплазму с едва различимыми органеллами. В дистрофически измененных клетках покровно-ямочного эпителия наблюдалось уменьшение количества секреторных мукоидных гранул, среди которых преобладали незрелые, с плотным содержимым и неровными контурами. Диспластические изменения эпителиоцитов выражались в увеличении размеров ядер, появлении крупных ядрышек, значительном снижении содержания внутриклеточного муцина.
При недифференцированном раке желудка преобладали атипичные клетки с гладкими, лишенными микроворсинок контурами. Клеточные ядра отличались большими размерами, с глубокими инвагинациями в нуклеолемме, придающими ядру причудливую двухлопастную или трехлопастную форму. Изучение желудка при недифференцированном раке на отдалении от первичной опухоли показало высокую степень развития атрофически-склеротических процессов слизистой оболочки и наличие диспластических изменений эпителия, ассоциированных с генеративными зонами (желудочные ямки, верхние отделы шеек желез). Неполная кишечная метаплазия носила очаговый характер и была ограничена, как правило, пилорическим отделом желудка. Анализ частоты и выраженности патологических изменений нетрансформированной слизистой оболочки при недифференцированном раке выявил их сходство с перифокальными процессами при диффузном типе карцином в первой группе наблюдений, что свидетельствует об определенном гистогенетическом единстве этих вариантов рака желудка.
Ультраструктурный анализ карцином желудка со смешанным типом строения подтвердил полиморфизм тканей и клеточную атипию, обнаруженные при светооптическом исследовании. В участках опухоли обнаружили злокачественные клетки с признаками секреции слизи в виде различных по размеру гранул, содержащих муцин. При снижении уровня дифференцировки по направлению к периферии опухоли наблюдалось прогрессирующее изменение ядерно-цитоплазматического соотношения в сторону увеличения размеров ядер. В слизистой оболочке желудка на отдалении от опухолевого очага в ряде случаев отсутствовали патологические изменения покровно-ямочного эпителия. По мере приближения к опухолевому очагу нарастала выраженность и гетерогенность изменений эпителиальных структур слизистой оболочки желудка. Анализ перифокальных процессов в окружающей слизистой оболочке желудка выявил меньшую распространенность и частоту предраковых изменений (дисплазии, неполные кишечные метаплазии и атрофии эпителия), чем в других исследованных группах пациентов. В целом, это свидетельствует о более высоких темпах опухолевой прогрессии смешанных форм карцином желудка.
Проведен комплексный морфологический анализ, включающий световую и электронную микроскопию опухолевых очагов, нетрансформированной слизистой оболочки, и регионарных лимфатических узлов при раке желудка. По результатам микроскопического исследования слизистой оболочки желудка на отдалении от опухолевого очага у пациентов с высоко- и умереннодифференцированными карциномами желудка установлено, что наиболее типичными изменениями являются распространенная неполная кишечная метаплазия и ассоциированная с этими участками дисплазия. В прилежащих к опухоли участках слизистой оболочки нередко обнаруживалась неравномерная гиперплазия эпителия. При низкодифференцированной и перстневидно-клеточной карциномах, а также при недифференцированном раке желудка на первый план выходит дисплазия генеративных зон эпителия; неполная кишечная метаплазия носит очаговый характер.
