маб в онкологии что это
Маб в онкологии что это
После многолетних исследований mAb заняли свое место среди противоопухолевых препаратов. Это стало возможным благодаря техническим достижениям, среди которых следующие.
1. Гуманизация мышиных антител, не приводящая к образованию к ним антител у человека.
2. Получение высокоаффинных антител с использованием бактериофагов.
3. Получение антител различного размера и обладающих различным сродством, а также различной способностью проникать в ткани.
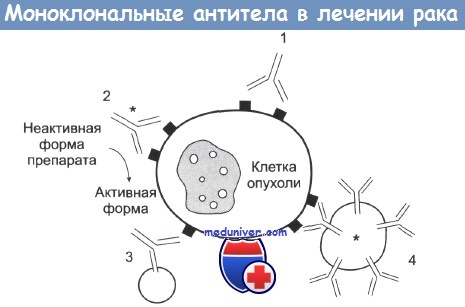
1 — антитело mAb связывается с антигеном опухолевой клетки и вызывает или ее комплемент-зависимую гибель, или гибель в результате антителозависимой атаки макрофагами.
2 — с mAb связан радиоактивный изотоп, токсин или цитокин, вызывающие гибель клетки. Также с антителами может быть связан фермент, участвующий в превращении препарата в активную форму.
3 — биспецифические mAb. Один сайт связывается с опухолевой клеткой, другой — с киллерной эффекторной клеткой.
4 — антитела mAb связаны с липосомами, которые содержат химотерапевтические препараты или токсины.
Существует много способов изменения антител для проявления у них противоопухолевого эффекта. Наиболее часто использующийся прием схематически представлен на рисунке. Подробности приведены в подписи к рисунку. Каждый из способов имеет свои возможности и ограничения.
1. Прямое цитотоксическое действие, вызываемое комплементом или антителами. При этом Fc-часть молекулы антитела должна связаться с Fc-рецептором (I или II) эффекторной клетки, но во избежание проявления ингибирующего эффекта не должна присоединяться к FcRIII. Таким механизмом цито-токсического действия обладает трастузумаб, который связывается с ERB В2 рецепторами опухоли молочной железы, а также ритуксимаб — mAb к CD20, применяющееся для лечении больных с В-клеточной лимфомой.
2. Примером mAb, доставляющих к раковой клетке токсин или радиоактивный изотоп, являются гуманизированные анти-CD33, конъюгированные с калихеамицином (гемтузумаб). Калихеамицин представляет собой агент, связывающийся с ДНК в области малой бороздки. CD33 экспрессируется на поверхности бластных клеток при остром миелоидном лейкозе. При рецидивах, устойчивых к медикаментозным препаратам, гемтузумаб вызывает ремиссию.
Подход с применением токсинов, например рицина, конъюгированных с mAb, не привел к получению клинических препаратов из-за высокой их токсичности для кровеносных сосудов. Присоединение к антителам радиоактивных изотопов (иттрия-90 или йода-131) представляет собой привлекательный путь, поскольку при этом появляется возможность воздействовать на опухолевые клетки, расположенные на некотором расстоянии от клетки-мишени. В настоящее время проходят клинические испытания aнmu-CD20, меченые иттрием-90 и анти-СЕА, меченые иодом-131.
Антитела, содержащие фермент, способный переводить лекарственный препарат в активную форму (ADEPT, antibody-dependent enzyme prodrug therapy), показали обнадеживающие результаты при лечении больных с метастазирующими колоректальными раками. Ферменты, конъюгированные с антителами, проявляют иммуногенные свойства, что ограничивает диапазон назначаемых доз.
3. Подход с использованием биспецифических антител пока еще находится на ранней стадии развития. Присоединение антител к эффекторным Т-клеткам вызывает мощный выброс цитокинов, приводящий к токсическим проявлениям. Это ограничивает применение подобных препаратов.
4. Иммунолипосомальные препараты являются эффективными средствами адресной доставки токсинов или радиоактивных изотопов к клеткам опухоли, однако получение их технически трудно. Эти препараты могут оказаться перспективными в случае, когда необходимо воздействовать на сосудистую систему опухоли.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение первично выявленного распространенного рака предстательной железы
Глава 9. Лечение первично выявленного распространенного рака предстательной железы
Тестостерон. Яички продуцируют около 95% всех андрогенов в виде тестостерона. В яичках он продуцируется клетками Лейдига в ответ на стимуляцию лютеинизирующим гормоном (ЛГ), который секретирует аденогипофиз в ответ на высвобождение рилизинг гормона лютеинизирующего гормона гипоталамуса. Соотношение гормонов определяется состоянием гипоталамо-гипофизарно-тестикулярной системы (рис. 20).
Рис. 20. Продукция тестостерона. Гипоталамо-гипофизарно-тестикулярная ось.
Механизм отрицательной обратной связи заключается в том, что при снижении уровней тестостерона гипоталамус высвобождает ЛГРГ, который в свою очередь стимулирует секрецию ЛГ, и, в конце концов, повышается секреция тестостерона. Механизм обратной связи приводит к возрастанию концентрации тестостерона, при этом уменьшаются выбросы ЛГРГ гипоталамусом.
Большая доля циркулирующего тестостерона в крови связана глобулином, связывающим половые гормоны (ГСПГ), и альбумином. Небольшая часть (2-3%) циркулирующего тестостерона не связана и, как считается, является функционально-активной формой тестостерона, который проникает в ткани предстательной железы. Свободный тестостерон пересекает мембрану клетки предстательной железы, а затем в цитозоле ферментом 5альфа-редуктазой превращается в ДГТ (рис. 21).
Рисунок 21. Механизм стимуляции функции клеток предстательной железы андрогенами.
Современные концепции лечения распространенного рака предстательной железы. Вопросы лечения гормонально-зависимых опухолей предстательной железы не могут решаться однозначно в связи со значительными изменениями, происходящими в организме больного. Это выдвигает необходимость всестороннего подхода к проблеме лечения рака предстательной железы, которая содержит еще целый ряд противоречивых вопросов.
Несмотря на то, что с тех пор, как Huggins и Hodges показали гормональную зависимость рака предстательной железы, прошло уже более 50 лет, гормонотерапия остается ведущим методом лечения распространенных форм этой опухоли. Однако эффект лечения в этих случаях временный. При наличии отдаленных метастазов рецидив заболевания возникает обычно в течение первых двух лет, а продолжительность жизни после появления рецидива обычно исчисляется месяцами. Сразу после внедрения гормонотерапии в клиническую практику начались споры об оптимальном времени ее проведения. В настоящее время гормонотерапию при распространенном раке предстательной железы стараются назначать как можно раньше в надежде на более позднее появление болевого симптома и увеличение продолжительности жизни. Однако правильность такого подхода ставится под сомнение некоторыми исследователями (Lepor Н., et al., 1982).
В 1985 году было начато исследование по сравнению немедленной и отсроченной гормонотерапии у больных с бессимптомным течением диссеминированного и местно-распространенного рака предстательной железы (Рабочая группа по изучению рака предстательной железы Совета по исследованиям в медицине, Англия). Набор больных был прекращен в конце 1993 года. Предварительные результаты этой работы были опубликованы в 1997 году. Авторы исследования получили данные о 934 больных. В группе больных, которым гормонотерапия проводилась отсрочено, 51 больной умер от сопутствующих заболеваний еще до начала лечения (только пять из этих больных были моложе 70 лет), еще 29 больных умерли до начала лечения от основного заболевания. Показанием для начала лечения одинаково часто служили как рост первичной опухоли, так и отдаленные метастазы. Появление отдаленных метастазов и боли в костях чаще наблюдались у больных, которым гормонотерапия проводилась отсрочено (р 0.033).
ГОРМОНАЛЬНАЯ ТЕРАПИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Абсолютное число заболевших в 2000 г. в России составило 11 039 человек. Радикальное лечение РПЖ (радикальная простатэктомия, дистанционная лучевая терапия и брахитерапия) возможно только при локализованной форме заболевания, которая диагностируется у 33,7% больных. На момент постановки диагноза 2/3 опухолей предстательной железы являются местно-распространенными или генерализованными [4].
Показанием к проведению гормонотерапии при раке простаты является наличие метастазов, местно-распространенный процесс (T3-4NxM0), принадлежность к группе высокого риска (т.е. ПСА > 10 нг/мл + Глисон >= 7, Глисон 8-10 независимо от Т и ПСА, ПСА > 20 нг/мл незаисимо от Т и Глисона, T2C-T4, N0, N+), а также повышение ПСА после радикальной простатэктомии и/или лучевой терапии.
Методами гормонотерапии при раке простаты являются хирургическая кастрация, медикаментозная кастрация агонистами или антагонистами ЛГРГ, применение антиандрогенов (стероидных или нестероидных), эстрогенов и других агентов, таких как кетоконазол, спиронолактон, аминоглютетемид, кальцитриол, аналоги соматостатина и финастерид.
До конца 80-х годов лечение III или IV стадии РПЖ сводилось к хирургической кастрации (билатеральная орхидэктомия) или к терапии эстрогенами. До настоящего времени в некоторых клиниках двусторонняя орхидэктомия является методом выбора при лечении генерализованного РПЖ. Терапевтический эффект наступает быстро у 60-80% больных с прогрессирующим РПЖ, невысокая стоимость лечения и относительная техническая простота выполнения операции до сих пор кажутся заманчивыми. Однако на сегодняшний день, данный метод не является \золотым\ стандартом [5]. Это связано со многими причинами. Во-первых, хирургическая кастрация позволяет избавить организм только от 60% вырабатываемых андрогенов, во-вторых, гормонорезистентный РПЖ встречается в 15- 30% случаев, применение хирургической кастрации в данном случае является не только бессмысленной, но и вредной манипуляцией, так как пагубно отражается на качестве жизни пациентов и, как и любое хирургическое вмешательство, сопряжено с определенным риском послеоперационных осложнений [6]. После этой операции нельзя проводить интермиттирующую андрогенную блокаду, которая, по данным ряда авторов, позволяет дольше поддерживать гормоночувствительность опухоли, а значит, и терапевтический контроль над ней. Также нельзя забывать о феномене отмены антиандрогенной терапии, в результате чего может наступить клиническая ремиссия [7]. Среднее время до прогрессирования составляет 12-33 месяца. Через 18-24 месяца у большинства больных развивается рефрактерность к дальнейшей гормональной терапии. После перехода заболевания в гормонорезистентную фазу медиана выживаемости составляет 23-37 месяцев (Hellerstedt, 2002).
Метод эстрогенотерапии при распространенном РПЖ также обладает невысокой стоимостью и достаточно высокоэффективен (объективный эффект отмечается у 70-80% больных). Однако по результатам многочисленных исследований данный вид лечения приводит к большому числу побочных реакций и осложнений (инфаркт миокарда, тромбоэмболии, нарушения функций печени, желудочно-кишечного тракта, задержка жидкости в организме, гипертония и др.), в то же время терапия эстрогенами уступает по эффективности современным методам андрогенной депривации.
В пятидесятых годах была сформулирована теория нейрогуморального контроля гипофиза со стороны гипоталамической подбугорной области головного мозга. Было выделено и изучено несколько гипоталамических гормонов, в том числе и релизинг- гормон. Его другое название лютеинизирующий гормон- релизинг гормон (ЛГРГ). Возникла идея путем создания различных аналогов ЛГРГ проконтролировать в нужном направлении синтез эндогенных половых гормонов (андрогенов). Эксплуатировались два подхода: создание агонистов ЛГРГ и антагонистов ЛГРГ. Первый связан с непрерывной стимуляцией гипофиза, в результате чего наступает сбой в регуляции синтеза половых гормонов. Введение агонистов обязательно должно быть повторено. Второй подход предусматривает немедленное подавление секреции гипофизарных гормонов антагонистами ЛГРГ [8]. Как оказалось, введение агонистов ЛГРГ приводит к тому, что наступает глубокое подавление синтеза гонадотропина, что приводит к полному расстройству гипофизарно- гонадной оси и заканчивается прекращением синтеза эстрогенов и тестостерона [9]. При этом кастрационный уровень тестостерона достигается в течение 2-3 недель после начала лечения. У больных, начавших лечение агонистами ЛГРГ, отмечается первичная гиперсекреция тестостерона (синдром \вспышки\). Для подавления клинических проявлений повышения уровня тестостерона (усиление костных болей и пр.) возможно применение антиандрогенов перед введением агонистов ЛГРГ. Разницы результатов применения различных препаратов данной группы не обнаружено. Не выявлено различий между результатами лечения агонистами ЛГРГ и ДСЭ при большей частоте сердечно-сосудистых осложнений со стороны эстрогенов (Seidenfeld, 2000).
Антагонисты ЛГРГ вызывают блокаду выработки ЛГ и ФСГ, приводя к резкому снижению продукции тестостерона. В рандомизированном исследовании доказано отсутствие эффекта \вспышки\, а также более быстрое достижение кастрационных уровней сывороточного тестостерона у пациентов, получавших антагонисты ЛГРГ.
Монотерапия антиандрогенами была предложена как метод андрогенной блокады, который может предотвратить побочные эндокринные эффекты, в том числе и подавление сексуальной функции. Монотерапия флутамидом продемонстрировала одинаковые отдаленные результаты с максимальной андрогеной блокадой (МАБ) и орхэктомией, уступив эстрогенам в отношении выживаемости и времени до прогрессирования (Pavone-Macaluso, 1994, Boccon-Gibod, 1997). Ципротерон-ацетат (ЦПА) в монорежиме продемонстрировал отдаленные результаты, аналогичные использованию эстрогенов (EORTC 30761). Бикалютамид в дозе 50 мг/сут уступал кастрации в отношении медианы выживаемости и времени до прогрессирования. Увеличение дозы до 150 мг позволило добиться результатов, аналогичным таковым при использовании МАБ, у пациентов со стадией М0 (Tyrell, 1998).
В урологическом отделении Российского онкологического научного центра им. Н.Н. Блохина РАМН было проведено исследование препарата \Билумид\, имеющим активное вещество бикалутамид.
В исследование были включены 15 пациентов, имеющих диагноз РПЖ T2-3N0M0, ранее не получавших специфического лечения. Пациенты получали Билумид в дозе 150 мг в сутки в монорежиме на протяжении 3-х месяцев. При контрольном обследовании выяснилось, что титр ПСА достоверно снизился у 100 % пациентов, а титр тестостерона сыворотки крови достоверно возрос у 94 %. Не было зарегистрировано ни одного случая почечной или печеночной токсичности, требующей отмены препарата.
Понятие МАБ подразумевает сочетание кастрации (медикаментозной или хирургической) и антиандрогенов, приводящих к блокаде как продукции тестостерона, так и его взаимодействия с рецепторами. Концепция МАБ впервые была предложена Labrie (1983), в работе которого 2-летняя выживаемость пациентов, получавших МАБ, была достоверно больше, чем у больных, подвергнутых только кастрации. Результаты автора были воспроизведены в нескольких исследованиях. Однако в ряде работ не было достигнуто преимуществ выживаемости при использовании МАБ по сравнению с кастрацией. Это послужило причиной проведения больших рандомизированных исследований, в которых были получены противоречивые результаты. В крупнейшем метаанализе, включившем данные более 8 000 больных преимуществ выживаемости в группе, получавшей МАБ, не выявлено (Seidenfeld,2000).
Было высказано предположение, что преимущество МАБ в ранних исследованиях обусловлено подавлением инициального повышения уровня тестостерона, вызванного введением агонистов ЛГРГ, антиандрогенами. В связи с этим производились попытки нивелировать данный фактор за счет применения хирургической кастрации, что не привело к разрешению проблемы. Так, в работе Moinpour (1998), рандомизировавшего больных на орхэктомию в сочетании с флутамидом или плацебо, 10-процентное преимущество выживаемости в первой группе было недостоверным. Напротив, в исследовании EORTC 30853, выживаемость пациентов, получавших МАБ, была значимо выше, чем в группе, подвергнутой кастрации.
С целью разрешения противоречий относительно реальной эффективности МАБ были выполнены многочисленные метаанализы результатов ряда исследований, в которых также получены противоречивые результаты. В метаанализе Bennett C.L. (1999), включившем 9 исследований (4128 больных) выявлено увеличение выживаемости в группе пациентов, получавших МАБ с включением флутамида, на 10%, по сравнению с больными, подвергнутыми кастрации. Аналогичные результаты получены в метаанализе 18 исследований (5 485 больных) The Agency for Health Care Policy Research, выявившем 3-9% увеличение 5-летней выживаемости при использовании МАБ. В другом метаанализе 20 исследований, включивших 6320 больных, отмечено умеренное увеличение продолжительности жизни без признаков прогрессирования у больных, получавших МАБ, по сравнению с кастрацией, при наблюдении в течение 1 года. Преимущество специфической и общей выживаемости оказались значимыми только при сроке наблюдения 5 лет. Denis L. (1994), проведший метаанализ 23 исследований, отметил преимущество МАБ с включением агонистов ЛГРГ и антиандрогенов только в отношении времени до прогрессирования.
В метаанализе 1997 г., включившем данные 5000 больных из 22 исследований не подтверждено увеличения продолжительности жизни у пациентов, получавших комбинированное лечение. В метаанализе результатов 29 исследований (1998) МАБ также не продемонстрировала преимуществ относительно кастрации.
В 2000 г. Prostate Cancer Trialists Collaborative Group (PCTCG) провела крупнейший метаанализ, включивший данные 8275 больных из 27 исследований. При этом выявлена тенденция к увеличению 5-летней выживаемости при использовании МАБ по сравнению с монотерапией (25.4% и 23.6% соответственно), однако разница результатов не достигла статистической значимости (2p=0.11).
При анализе данных подгрупп пациентов отмечена зависимость результатов лечения от вида применявшихся антиандрогенов. Стероидные антиандрогены (флутамид, бикалютамид, нилютамид) в составе комбинированного лечения обеспечивали значимое преимущество МАБ перед кастрацией (2p
Материалы конгрессов и конференций
IV РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
РАЦИОНАЛЬНЫЕ ВАРИАНТЫ ГОРМОНОТЕРАПИИ РАСПРОСТРАНЕННОГО РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ.
Б.П. Матвеев, Б.В. Бухаркин.
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
С тех пор, как Huggins и Hodges показали гормональную зависимость рака предстательной железы, прошло уже более 50 лет, однако гормонотерапия по-прежнему остается ведущим методом лечения распространенных форм этой опухоли. Необходимо, между тем, четко понимать, что речь идет о паллиативном лечении, эффект от которого временный. При наличии отдаленных метастазов прогрессирование заболевания возникает обычно в течение первых двух лет, а продолжительность жизни после появления признаков прогрессии, как правило, исчисляется месяцами.
Стандартные методы гормонотерапии рака предстательной железы хорошо известны клиницистам, многократно обсуждались. Поэтому мы хотим остановиться лишь на некоторых современных концепциях лечения этого заболевания, которые, на наш взгляд, представляются важными. Когда начинать лечение? Что может дать монотерапия антиандрогенами в высоких дозах? Насколько необходима максимальная андрогенная блокада (МАБ)? Каковы возможности интермиттирующей терапии?
Сразу после внедрения в клиническую практику гормонотерапии начались споры об оптимальном времени ее проведения. В настоящее время гормонотерапию при распространенном раке предстательной железы стараются назначать как можно раньше в надежде на более позднее появление болевого синдрома и увеличение продолжительности жизни. Однако правильность такого подхода некоторыми исследователями (Lepor H., et al.,1982) ставится под сомнение.
Некоторые авторы предлагают альтернативную тактику лечения, исходя из того, что проведение гормонотерапии можно отложить до появления признаков прогрессирования заболевания. В этом случае лечение может позволить добиться ремиссии, и продолжительность жизни больного будет не меньше, чем при немедленном начале лечения. На основании данных рандомизированных исследований Объединенной группы исследований в урологии The Veterans Administration Cooperative Urological Research Group (VACURG) Byar D.P. делает вывод о том, что «гормонотерапия при раке предстательной железы может быть отсрочена. «. В этих работах не было выявлено неблагоприятных последствий отсроченного лечения и было отмечено, что многие больные с распространенным раком предстательной железы (по данным VACURG- 41%) умирают от сопутствующих заболеваний. Таким образом, ряд исследователей считает, что отсроченная гормонотерапия при раке предстательной железы имеет преимущества перед начатой сразу после постановки диагноза (Kirk D.,1987).
Более поздние исследования (Рабочая группа по изучению рака предстательной железы Совета по исследованиям в медицине, Англия), предварительные результаты которых были опубликованы в 1997 году, позволили авторам сделать вывод о более высокой эффективности раннего, сразу после постановки диагноза, начала гормонотерапии. Однако данные для подгрупп больных, у которых на момент постановки диагноза отсутствовали отдаленные метастазы, еще не окончательны.
Большинство методов эндокринотерапии рака предстательной железы направлено на снижение уровня тестостерона в крови путем подавления его синтеза в яичках и коре надпочечников. Возможные варианты и методы андрогенной блокады представлены в таблице.
Идеальная терапия рака предстательной железы включает блокаду действия андрогенов на клеточном уровне предстательной железы, что реализуется снижением связывания дигидротестостерона с ядерным рецептором при конкурентном торможении или снижении концентрации цитоплазматического рецептора андрогенов.
Для блокады циркулирующих андрогенов используются как стероидные, так и нестероидные антиандрогены (андрокур, флуцином, анандрон, касодекс). Эти препараты нашли широкое применение в клинической практике, их эффективность хорошо изучена и прекрасно известна клиницистам.
Из современных концепций лечения распространенного рака предстательной железы заслуживает внимание монотерапия антиандрогенами. Результаты всех исследований, в которых оценивали эффективность монотерапии антиандрогенами, предоставили убедительные доказательства активности и в целом хорошей переносимости нестероидных антиандрогенов. Важным остается вопрос, можно ли добиться повышения эффективности лечения при повышении дозы, и какова эффективность монотерапии антиандрогенами в сравнении с таким стандартным методом, как кастрация. Целью ряда международных исследований стало установление эффективности больших доз касодекса (150 мг) в монотерапии. Значительный интерес представляют результаты, приведенные Iversen P. с соавт. (1998), проведших сравнительный анализ монотерапии касодексом и кастрации (хирургической или медикаментозной). В исследование были включены 1453 пациента с распространенным раком предстательной железы Т3-4М0 или доказанным М1. Анализ проводился после 4 лет наблюдения. В результате было показано, что для пациентов без метастазов действие касодекса эквивалентно кастрации и может являться альтернативой как хирургической, так и медикаментозной кастрации. У пациентов с отдаленными метастазами продолжительность жизни была на 42 дня больше в группе кастрации. Однако анализ качества жизни продемонстрировал значительное преимущество касодекса. Так, пациенты, получавшие 150 мг касодекса, сохраняли либидо и половую потенцию, а также физическую работоспособность на достоверно более высоком уровне, чем больные подвергнутые кастрации. Эти преимущества в качестве жизни чрезвычайно важны, учитывая паллиативный характер лечения. Таким образом, некоторое уменьшение времени выживания компенсируется значительным улучшением качества жизни. Аналогичные результаты представлены и в исследованиях Р. Schellhammer (1999), F.H. Schroder (1999), G.J. Kolvenbag, A. Nash (1999) и ряда других авторов. Однако на сегодняшний день еще нет достоверных данных о преимущественной эффективности данного вида лечения по сравнению со стандартными методами.
Использование аналогов ЛГРГ (LHRH) позволило добиться эффекта кастрации медикаментозным путем. Препараты этой группы (золадекс, лейопролид, декапептил, деферелин и др.) достаточно давно и прочно вошли в арсенал гормональных средств, применяемых для лечения распространенных форм рака предстательной железы.
В лечении диссеминированного рака предстательной железы в последние два десятилетия нашло широкое распространение использование комбинации кастрации (хирургической или медикаментозной) и антиандрогенов. Такая комбинация получила название максимальной андрогенной блокады (МАБ).
Итоги многолетнего опыта применения МАБ подведены на двух международных консультациях по раку простаты (Монако,1996 и Париж,1999). Было отмечено, что в большинстве случаев применение МАБ по результатам сравнимо с кастрацией. Небольшое преимущество данный метод лечения имеет у больных с минимальным распространением болезни (единичные костные метастазы или поражение регионарных лимфатических узлов). Использование МАБ оказывает хорошее симптоматическое действие и способствует улучшению качества жизни больных, имеющих метастазы.
Однако, как при любом виде гормональной терапии, через какой-то промежуток времени МАБ теряет эффективность. В случае прогрессирования заболевания на фоне МАБ рекомендуется отменить лечение антиандрогенами, так как известен так называемый «синдром отмены антиандрогенов». После отмены антиандрогенов у 10-15% больных наступает временная стабилизация заболевания. Немаловажным аспектом, особенно для России, является экономическая сторона вопроса. Стоимость проведения МАБ очень высока, так как требует длительного применения дорогостоящих препаратов.
В последнее время появились сообщения о возможности проведения прерывистого лечения, так называемой интермитирующей блокады. Результаты рандомизированных исследований еще не получены. Однако предварительные данные свидетельствуют о том, что прерывистое назначение гормональных препаратов может длительно сохранить чувствительность к антиандрогенам и улучшает качество жизни, что связывается с восстановлением сексуальной функции и уменьшением побочных эффектов от длительного применения препаратов. При данном подходе значительно снижается стоимость лечения. Интермиттирующая блокада становится популярным методом лечения распространенного рака предстательной железы, однако, еще нет убедительных данных, что такой подход имеет преимущество в отношении продолжительности жизни по сравнению со стандартными видами лечения.
На 2-й международной консультации по раку простаты (Париж,1999) обсуждалась новая стратегия «step-up», при которой лечение начинается с монотерапии антиандрогенами, а аналоги LHRH добавляются при прогрессировании процесса (Reijke T.,1999). Все эти новые концепции пока находятся в стадии разработки, однако, они представляются прогрессивными по сравнению с принятыми стандартами.
В настоящее время большинство специалистов, занимающихся лечением больных раком предстательной железы, назначая тот или иной вид терапии, обязательно руководствуются не только стадией заболевания, но и анализом прогностических факторов, таких как уровень ПСА и динамика его изменения в процессе лечения, степень активности пациента, степень злокачественности опухоли и рядом других.
Исходя из анализа современной литературы и собственного опыта, мы рекомендуем обсудить следующую тактику первой линии лечения больных распространенным раком предстательной железы.

