локальный рецидив опухоли что это
Лечение рецидива рака
Даже после успешно проведенного лечения злокачественных новообразований остается риск, что болезнь вернется, потому что в организме остались раковые клетки. По статистике, в ¾ случаев в течение 5 лет после лечения случаются рецидивы рака — именно поэтому врачи говорят о ремиссии, а не о выздоровлении. Наиболее опасны ранние, возникающие в течение нескольких месяцев после терапии, — они агрессивны и часто ведут к гибели пациента. Поэтому наблюдение у врача после операции и/или курса химио- и лучевой терапии является обязательным — оно позволяет своевременно заметить ухудшение ситуации и принять меры.
Затрудняет ситуацию то, что при рецидивах рака симптомы могут отличаться от тех, которые были ранее, — только в трети всех случаев обнаруживаются в той же локализации, гораздо чаще страдают соседние органы и ткани. Отличаются и сами симптомы, и их интенсивность. Поэтому необходимы регулярные осмотры, анализы крови для определения уровня РЭА и других онкомаркеров, при подозрении на возвращение проблемы — МРТ, КТ и другие исследования. Они позволяют своевременно принять меры, не давая процессу зайти слишком далеко.
Нам доверяют 9500 пациентов ежегодно.
Какие виды рака повторно выявляются чаще других
На риск возврата болезни влияет не только локализация на момент лечения — большое значение имеет то, из каких клеток развивалась опухоль, стадия, на которой проводилось лечение, степень дифференциации раковых клеток, а также образ жизни пациента.
Врачи и пациенты сталкиваются с рецидивами рака желудка, легкого, щитовидной или молочной железы, мужчины — простаты, женщины — матки и яичников и др. Общие рекомендации для всех пациентов относятся к образу жизни:
Кроме того, есть и специфические рекомендации, связанные с прооперированным органом, которые помогут при раке снизить риск рецидива после операции — в основном они касаются специфических исследований и приема необходимых препаратов.
Рецидивы рака: лечение и прогноз
При повторном выявлении злокачественных опухолей проводятся диагностические мероприятия, чтобы уточнить, они единичные или множественные, это новый первичный очаг или он развился из остатков ранее удаленного, те же ткани стали основой для новообразования или они отличаются от предыдущего случая, в каких органах расположены, объем метастазирования, если он есть и т.д.
Все это влияет на выбор лечебной тактики — если ранее применяемые методики не дали результата, их заменяют другими. Как правило, лечение проводят комплексно, сочетая хирургию, радиотерапию и химиопрепараты, также их могут дополнять иммуно-, гормонотерапия и другие вспомогательные инструменты.
При ранних рецидивах после рака прогноз менее благоприятен, чем при возвращении болезни через год или более — это говорит о более агрессивном течении недуга. Повысить свои шансы на долгую жизнь можно, изменив образ жизни: отказавшись от курения, нормализовав питание и снизив массу тела при ожирении, регулярно давая телу умеренные нагрузки.
Чтобы своевременно среагировать на ухудшение состояния, необходимо регулярно проводить обследование. Все диагностические процедуры и, при необходимости, лечение вы можете получить в Клинике НАКФФ. Телефон для записи +7(495) 023-56-96.
Последние новости
Последние статьи
Рейтинг: 4.9/5 Голосов: 110
Локальный рецидив опухоли что это
Материалы и методы исследования
В исследование включено 23 больных СМТ (13 мужчин и 10 женщин), которым в отделении общей онкологии ГУ РОНЦ им. Н.Н. Блохина РАМН в 1990-2003 гг. проведено повторное хирургическое вмешательство в объеме широкого иссечения опухоли после нерадикального удаления опухоли в различных медицинских учреждениях России. Средний возраст пациентов составил 42±30,6 года (от 14 до 75 лет), четверо больных были старше 60 лет. Общая характеристика пациентов представлена в таблице 1.
Таблица 1. Общая характеристика больных СМТ
Характеристика
Число больных (n=23)
Средний возраст (годы)
Таблица 2. Общая характеристика опухолевого процесса у больных СМТ
Характеристика опухолевого процесса
Число больных (n=23)
Локализация опухоли
Передняя грудная стенка
Гистологический тип опухоли
Злокачественная фиброзная гистиоцитома
После дополнительной операции в связи с высокой злокачественностью опухоли (G2-3) 16 (69,6%) пациентов получили адъювантную химиотерапию (доксорубицин в комбинации с цисплатином, циклофосфаном, винкристином, дакарбазином) и 2 (8,7%) – лучевую терапию (СОД до 40 ГР).
Статистическую обработку материала проводили стандартным пакетом «STATISTICA 5.11». Выживаемость оценивали по методу Kaplan-Meier.
Результаты исследования
Средний период наблюдения за 23 больными СМТ после широкого иссечения опухоли составил 8,3±4,2 лет (от 0,5 до 12 лет). Сроки выполнения дополнительной операции колебались от 3 до 6 недель после нерадикального удаления опухоли и в среднем составили 4,8±1,3 недели. При микроскопическом исследовании тканей, иссеченных во время дополнительной операции, у 16 (69,6%) больных выявлена резидуальная опухоль преимущественно в зоне послеоперационного рубца, у остальных 7 (30,4%) пациентов элементы опухоли не визуализировались. В крае резекции опухолевых клеток не было ни у кого из 23 больных СМТ.
Локальные рецидивы
Рецидивы диагностированы через 1, 1,8, 2,5 и 4 года после широкого иссечения СМТ. Во всех 4 случаях первичная опухоль располагались под мышечной фасцией (Т2b), и её размеры превышали 5 см. Кроме того, при микроскопическом исследовании ткани, иссеченной во время первой нерадикальной операции, у всех 4 пациентов была выявлена резидуальная опухоль. В таблице 3 представлены рецидивы после широкого иссечения.
Таблица 3. Общая характеристика опухолевого процесса у больных с локальным рецидивом СМТ
Гистологический тип опухоли
pTNM стадия опухоли
Степень злокачествен-ности опухоли
Злокачественная фиброзная гистиоцитома
Отдаленные метастазы
У 6 (26,1%) из 23 пациентов возникли отдаленные метастазы. У 3 больных были поражены легкие, у 1 – печень, у 1 – легкое и лимфатические узлы средостения, у 1 – легкое и поясничный позвонок. У 2 больных отдаленные метастазы сочетались с локальным рецидивом, о чем сообщено выше. Отдаленные метастазы возникли через 1,5, 1,8, 2, 2,1, 2,4 и 2,5 лет после широкого иссечения СМТ. Характеристика этих опухоли представлена в таблице 4.
Таблица 4. Общая характеристика опухолевого процесса у больных с метастазами СМТ
Гистологи-ческий тип опухоли
pTNM стадия опухоли
Степень злокачес-твенности опухоли
Легкое, лимфоузлы средостения
Злокачес-твенная фиброзная гистиоцитома
Легкое, II поясничный позвонок
Передняя грудная стенка
За время наблюдения 5 (21,7%) из 23 пациентов умерли от прогрессирования заболевания. Все пятеро имели отдаленные метастазы, двое – метастазы и локальный рецидив. Восемнадцать (78,3%) больных живы, у троих (13%) отмечено прогрессирование болезни. Двум из них по поводу локального рецидива выполнено радикальное иссечение рецидивной опухоли, третьему по поводу метастаза в легкое и поясничный позвонок проведена торакотомия, вертебропластика и лучевая терапия на область поясничных позвонков.
Общая и опухолеспецифическая 5-летняя выживаемость больных составила 78%, 5-летняя выживаемость без признаков прогрессирования заболевания – 65% (рис. 1).
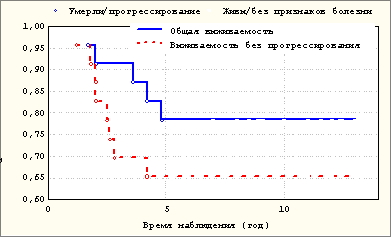
Рисунок 1. Общая 5-летняя выживаемость больных СМТ после дополнительной широкой резекции опухоли и 5-летняя выживаемость больных СМТ без признаков прогрессирования заболевания после дополнительной широкого иссечения опухоли
Обсуждение
По данным литературы [2, 6, 14, 22], общая 5-летняя выживаемость больных после первичного широкого иссечения СМТ составляет 70-80%. В исследовании Sugiura et al. [20] общая 5-летняя выживаемость больных после повторного широкого иссечения опухоли достигла 93% при уровне 5-летней выживаемости без признаков прогрессирования заболевания 84%. В нашем исследовании общая 5-летняя выживаемость пациентов, перенесших повторное широкое иссечение СМТ, составила 78%, 5-летняя выживаемость без признаков прогрессирования болезни – 65%. Полученные нами результаты дополнительной операции, выполненной в течение 3-6 недель после нерадикального удаления опухоли, аналогичны результатам первичного широкого иссечения СМТ.
Мы согласны с мнением Kawaguchi et al [17] и Sugiura et al. [20], что во избежание рецидивов край широкого иссечения опухоли должен быть не менее 3 см. Соблюдение данного норматива способствовало достаточно низкому уровню локального рецидива как в нашем исследовании (17,4%), так и в исследовании группы Sugiura [20] (8,8%). Наиболее точные границы иссекаемых тканей могут быть определены на основании данных КТ, МРТ исследований, 3Д реконструкции с учетом фасциальных пространств конечностей [1].
Наличие опухолевых клеток по краю резекции при микроскопическом исследовании значительно повышает вероятность развития локального рецидива и отдаленных метастазов, а также ухудшает выживаемость больных [14]. Метастазы СМТ являются причиной смерти большинства пациентов не зависимо от наличия локального рецидива [2, 9, 10, 16]. Как и другие авторы [3, 13], мы считаем, что локальный рецидив не играет определяющей роли в развитии отдаленных метастазов. В исследовании, проведенном нами, отдаленные метастазы возникли у 6 больных, только у 2 из них был локальный рецидив. На наш взгляд, одной из возможных причин метастазирования, наряду с высокой злокачественностью опухоли, может быть и резидуальная опухоль, выявленная у всех 6 пациентов после первой операции, выполненной нерадикально. Первое местное иссечение СМТ, вероятно, привела к диссеминации опухоли и последующему развитию отдаленных метастазов.
Авторы: Б.Ю.Бохян, Р.М.Карапетян, С.М.Иванов, Н.И.Мехтиева
Список литературы
Рецидивы рака молочной железы после органосохраняющего лечения
Пак Д.Д., Рассказова Е.А.
Московский научно-исследовательский онкологический институт им. П.А. Герцена, Москва
Рассмотрены особенности рецидивов рака молочной железы в зависимости от возраста пациенток, гистологического типа опухолевого узла, проведения лучевой терапии, а также от иммуногистохимических данных.
Проведен ретроспективный анализ результатов лечения 435 пациенток, которым с 2000 по 2006 гг. выполнены органосохраняющие операции (радикальные резекции) при раке молочной железы.
Характеристика пациенток по стадиям: 0 – 5 (1,1%), I – 181 (41,3%), IIА – 154 (35,3%), IIБ – 44 (10%), IIIА – 51 (11,6%), IIIВ – 1 (0,2%), IIIС – 2 (0,5%). Лучевая терапия проведена у 296 (67,6%) больных.
По стандартам лечения с учетом показаний проводили курсы полихимиотерапии по схемам CAF, АС, ТАС, АТ. Число курсов полихимиотерапии составило 4-6.
За 5-летний срок наблюдения диагностированы рецидивы у 10 (2,3%) больных, до 10-летнего срока наблюдения – у 20 (4,6%).
Самый высокий процент рецидива выявлен при НЕR2-подтипе РМЖ (10%), на 2 месте – трижды-негативный РМЖ (6,1%), на 3 месте – люминальный А подтип (3,1%).
Лечение рецидивов заключалось в следующем: удаление оставшейся части молочной железы – у 14 пациенток, их которых у 5 удаление молочной железы дополнено интраоперационной ФДТ, у 5 – подкожное удаление молочной железы с одномоментной реконструкцией, что связано с возможностью данного вмешательства. Одной пациентке из-за множественных отдаленных метастазов проведена полихимиотерапия.
Заключение. С учетом новых данных о подтипах РМЖ и результатов нашего исследования можно рекомендовать не выполнять лучевую терапию после органосохраняющих операций при узловых образованиях 1 см и меньше, при благоприятных морфологических критериях (отсутствие мультицентричности, раковых эмболов по периферии узла и в ткани молочной железы, отсутствие инвазивного протокового рака III степени злокачественности, а также трижды-негативного и НЕR2 подтипа РМЖ).
На частоту появления рецидивов влияют стадия РМЖ, молодой возраст пациенток, гистогенез и подтип опухоли. При сочетании неблагоприятных прогностических факторов следует прибегать к реоперации на молочной железе.
Ключевые слова: молочная железа, органосохраняющее лечение, рецидивы рака молочной железы.
Рак молочной железы (РМЖ) занимает 1 место в структуре онкологической заболеваемости в РФ среди женского населения и имеет постоянную тенденцию к росту. В настоящее время в России ежегодно регистрируют более 50 000 новых случаев рака молочной железы (в 2009 г. – 54 315) и более 23 000 смертей (в 2009 г. – 23 517), при этом у 62% заболевших выявляют относительно ранние (I-II) стадии заболевания. Следует отметить, что в России за последние 10 лет удельный вес I-II стадий РМЖ возрос на 10%, увеличилось число больных, выявленных при профилактических осмотрах (с 14,9% до 21,9%).
За последние годы сделано много важных разработок в хирургическом лечении пациенток с РМЖ. При начальных стадиях заболевания возможно выполнение органосохраняющих операций с или без реконструктивно-пластического компонента. Лечение планируют при участии хирурга, химиотерапевта, радиолога и морфолога, что позволяет наилучшим образом сочетать локальные и системные методы терапии.
В последние годы наметились новые подходы к лечению РМЖ, связанные с уменьшением объема оперативного вмешательства на молочной железе и на лимфатических путях без нарушения онкологического радикализма. Среди причин отхода от устоявшейся в течение десятилетий агрессивной хирургической тактики:
Радикальная резекция молочной железы является органосохраняющей операцией и предусматривает удаление сектора молочной железы вместе с опухолью, части подлежащей фасции большой грудной мышцы, а также подключичной, подмышечной, подлопаточной клетчатки с лимфатическими узлами в едином блоке. При этой операции удаляют не менее 1/4 или 1/3 молочной железы, отступая 3-3,5 см от пальпируемого края опухоли. При локализации опухоли в медиальных отделах молочной железы операция может быть выполнена из двух разрезов кожи – на молочной железе и в подмышечной области. Радикальную резекцию молочной железы выполняют с обязательным интраоперационным морфологическим исследованием соскобов с краев резекции молочной железы.
В мире наиболее часто используемыми вариантами органосохраняющих операций являются лампэктомия (в российском варианте – секторальная резекция с подмышечной лимфаденэктомией) и квадрантэктомия (радикальная резекция).
Рандомизированное исследование результатов двух операций – лампэктомии и квадрантэктомии – было проведено в 1990 г. В исследование были включены больные с максимальным размером опухоли до 2,5 см (всего 705 пациенток). Всем больным проводили послеоперационное облучение. Развитие отдаленных метастазов и выживаемость больных в группах оказались идентичными, но у больных, перенесших лампэктомию, местный рецидив развивался достоверно чаще, чем у оперированных в объеме квадрантэктомии (7,0% и 2,2% соответственно).
С 1973 г. в Национальном институте по лечению рака (Милан) проводилось рандомизированное исследование, в которое включались больные с размером первичной опухоли до 2 см и без пальпируемых подмышечных метастазов. Радикальная мастэктомия по Halsted была выполнена 349 больным (1-я группа), квадрантэктомия с послеоперационным облучением – 352 (2-я группа). Квадрантэктомия предполагала иссечение опухоли и 2-3 см прилежащей здоровой ткани молочной железы с подлежащей фасцией и кожей, а также подмышечную лимфаденэктомию всех трех уровней. Если опухоль локализовалась в верхненаружном квадранте, то ее удаление и лимфаденэктомию выполняли единым блоком. Статистически значимых различий между группами больных по безрецидивной и общей выживаемости не отмечено.
Наконец, минимальная по объему удаляемой ткани молочной железы лампэктомия (lump – глыба, кусок, комок) была разработана в ходе исследований Национального проекта дополнения операций на молочной железе и кишечнике (NSABBP, США). При такой операции выполняли удаление опухоли и лимфаденэктомию из двух отдельных разрезов: через дугообразный кожный разрез, ориентированный по кожным складкам (иссечение кожи и подлежащей фасции было необязательным, запас здоровых тканей железы не регламентировался) удаляли опухоль; через кожный разрез, пересекающий подмышечную область в горизонтальном направлении, проводили лимфаденэктомию. В исследование входили больные (n=1851) с величиной опухоли не более 4 см. Сравнивали группы больных с лампэктомией (1-я группа), лампэктомией с лучевой терапией (2-я группа), модифицированной радикальной мастэктомией (3-я группа). При поражении лимфатических узлов проводили адъювантную химиотерапию. При 12-летнем наблюдении местный рецидив в молочной железе развился у больных 1-й группы в 35% случаев, 2-й группы – в 10%. Достоверные различия общей выживаемости и выживаемости без отдаленных метастазов между сравниваемыми группами отсутствовали. Общий вывод о равной эффективности органосохраняющего лечения и радикальных мастэктомий подтвержден и при 20-летнем наблюдении. Частота местного рецидива после лампэктомии составила 39,2%, после лампэктомии с облучением – 14,3% (p
| Авторы | Частота местного рецидива после | Показатели общей выживаемости | |
|---|---|---|---|
| органосохраняющего лечения | РМЭ | ||
| V.V. Vishnyakova и соавт. | 9,1% (7-летние) | 2,6-3,7% | Одинаковы |
| U. Veronesi и соавт. | 8,8% (20-летние) | 2,3% | Одинаковы |
| B. Fisher и соавт. | 39,2-14,3% (20-летние) | Одинаковы | |
| J.A. Van der Hage и соавт. | 10,8% | 5,9% | Одинаковы |
| С.М. Портной и соавт. | 4,0-5,5% | 2,4% | Одинаковы |
На основании сравнительного анализа рандомизированных и нерандомизированных клинических исследований различных вариантов органосохраняющего лечения рака молочной железы I и IIА стадий можно сделать вывод, что объем оперативного вмешательства не оказывает существенного влияния на результаты 5-летней выживаемости.
В последнем метаанализе EBCTCG, оценивающем вклад лучевой терапии в органосохраняющее лечение РМЖ, сравнивали две грандиозные группы больных: 3673 – органосохраняющая операция с лучевой терапией и 3638 – только органосохраняющая операция. Лучевая терапия снижала не только частоту местного рецидива более чем в 3 раза (относительный риск 0,31; 2p
| Группа больных | Характер органосохраняющего лечения | Число больных | Стадия | 5-летние результаты, % | Местные рецидивы | Отдаленные метастазы | Выживаемость |
|---|---|---|---|---|---|---|---|
| I | Секторальная резекция + Д1 | 2441 | I-IIА Т1-2N0М0 | 7,6-40,4 | 10,1 | 92,8 | |
| II | Туморэктомия или секторальная резекция + ЛТ | 3478 | I-IIА Т1-2N0М0 | 7,1-13,5 | 10,5 | 91,8 | |
| III | Туморэктомия или секторальная резекция с Д1 + ЛТ | 6560 | I-IIА Т1-2N0М0 (опухоль до 4 см) | 6,2-10,2 | 7,8 | 87,3 | |
| IV | Радикальная резекция | 286 | I-IIА Т1-2N0М0 | 4,6-9,1 | 8,7 | 89,4 | |
| V | Радикальная резекция + ЛТ | 800 | I-IIА Т1-2N0М0 | 4,2-4,6 | 9,2 | 92,6 | |
| ВСЕГО | 13785 | ||||||
Для больных I группы показатель общей выживаемости составил 92,8%, II группы – 91,8%, III группы – 87,3%, IY группы – 89,4%, V группы – 92,6%. Достоверно чаще местные рецидивы встречались в I группе больных, у которых органосохраняющие операции выполнены без удаления лимфатических узлов регионарных зон и дополнительной лучевой терапии. Частота местных рецидивов в среднем составила 28,6%. Среди больных, получавших дополнительное лечение, в послеоперационном периоде этот показатель был примерно в 3-4 раза меньше и составил от 8,4% до 2,4%. Приведенные данные позволяют сделать вывод, что лучевая терапия после органосохраняющих операций достоверно снижает частоту местных рецидивов рака. Отдаленные метастазы РМЖ I-IIА стадии во всех группах наблюдали примерно одинаково, независимо от методов органосохраняющего лечения.
Принципиальным в выборе пациенток для органосохраняющих операций является стадия опухолевого процесса. Однако стадия рака, учитывающая в основном количественную характеристику опухолевого процесса и его распространенность, не отражает другие весьма важные стороны заболевания: биологическую и митотическую активность опухоли, темп ее роста, гетерогенность опухолевых клеток, реактивность организма и гормонального статуса, что в конечном итоге определяет прогноз заболевания. Хирургическое вмешательство должно быть одновременно радикальным и абластичным, но в то же время преследовать задачу ранней реабилитации. Поэтому при выполнении органосохраняющих операций необходимо стараться сохранить форму молочной железы, тем самым уже на хирургическом этапе решая задачу улучшения качества жизни больных.
Остановимся на особенностях возникновения местного рецидива РМЖ. При анализе результатов органосохраняющих операций неизбежно возникает вопрос: действительно ли развитие местного рецидива в молочной железе не приводит к повышению риска диссеминации процесса и ухудшению общей выживаемости?
Одни авторы считают рецидив только местным процессом, при возникновении которого своевременно выполненная мастэктомия или удаление рецидива с повторным облучением решают проблему для большинства больных. В результате показатели общей выживаемости групп пациенток статистически значимо не различались.
Другие считают, что возникновение рецидива предшествует генерализации онкологического процесса, исходя из того, что рецидивная опухоль является источником диссеминации или к началу лечения болезнь была уже распространенной, а местный рецидив явился маркером активации опухолевого процесса.
Возможна двоякая трактовка этих результатов: а) рецидивная опухоль является источником диссеминации опухоли; б) к началу лечения болезнь уже была диссеминирована, местный рецидив является только маркером активности опухолевого процесса, следовательно, объем операции, проведение лучевой терапии не имеют значения для выживаемости больных.
Как писали B. Fisher и соавт. (1991), «связь между местным рецидивом и отдаленным метастазированием не является причинной. Отдаленные метастазы возникают с равной частотой как у больных с органосохраняющей операцией, так и с мастэктомией. Местный рецидив – предсказатель риска, а не причина отдаленных метастазов».
Еще один негативный фактор при органосохраняющих операциях – наличие опухолевых клеток в перитуморальных сосудах. Данный фактор напрямую связан с отдаленным метастазированием и при отсутствии адъювантной химиотерапии повышает вероятность развития отдаленных метастазов у больных, независимо от объема оперативного пособия на молочной железе.
При инвазивном протоковом раке частота раковой эмболии в кровеносных сосудах колеблется от 21% до 75%, экстратуморальную эмболию выявляют в 25%, при этом у 91-100% этих больных наблюдается метастатическое поражение лимфатических узлов. Одни авторы считают инвазию кровеносных сосудов плохим прогностическим признаком только при поражении двух и более лимфатических узлов. Другие полагают, что прогностическое значение этого признака играет роль только при отсутствии метастазов в лимфатических узлах, когда риск рецидива у больных с инвазией сосудов в ткани железы в 4,7 раза выше по сравнению с группой больных с отсутствием данного признака. При инвазии сосудов в ткани железы частота рецидивов составляет от 14; до 29,5%.
Основным методом борьбы с рецидивами является лучевая терапия.
По данным ЕSMO, послеоперационная лучевая терапия рекомендуется всем больным, перенесшим органосохраняющие операции. Облучение всей молочной железы снижает риск развития местного рецидива на 2/3, а подведение дополнительного буста снижает его еще на 50%. Кроме того, лучевая терапия оказывает положительное влияние на выживаемость. В целом, облучение бустами показано и пожилым больным, но может не проводиться при сочетании факторов низкого риска местного рецидива (широкие края резекции, N0, отсутствие сосудистой инвазии). У больных старше 70 лет с гормонозависимыми опухолями, максимальной стадией рТ1N0 и негативными краями резекции возможен отказ от лучевой терапии без ущерба выживаемости. Частичное облучение молочной железы вне рамок клинического исследования не рекомендуют.
При органосохраняющих операциях облучают молочную железу РОД 1,8-2 Гр до СОД 45-50 Гр, при подведении буста доза обычно составляет 10-16 Гр фракциями по 2 Гр, регионарные зоны облучают при медиальной локализации опухоли (облучение парастернальных лимфатических узлов РОД 2 Гр до СОД 46 Гр). При поражении лимфатических узлов облучают зоны регионарного метастазирования РОД 2 Гр до СОД 46 Гр.
Возможны более короткие схемы фракционирования (16 фракций по 2,66 Гр), которые обладают примерно такой же эффективностью и сопоставимыми побочными эффектами, но должны использоваться с осторожностью у молодых пациенток или после дополнительного облучения регионарных зон, т.к. эти категории больных либо вовсе не оценены в соответствующих клинических исследованиях, либо их количество было минимальным. При отказе от облучения после экономных операций локальный рецидив развивается у 15-40% больных.
Однако в 2010 г. канадские исследователи пришли к выводу, что при раннем раке молочной железы 3-недельный курс облучения более высокими дозами столь же эффективен, как и стандартная 5-недельная лучевая терапия. 10-летний риск локального рецидива у 662 женщин, получивших короткий курс облучения, составил 6,2% против 6,7% у 612 женщин после стандартной лучевой терапии. Кроме того, хороший косметический эффект через 10 лет отмечен у 71,3% пациенток, прошедших стандартное облучение, и у 69,8% женщин, получивших укороченный курс.
В НИИ онкологии им. Н.Н. Петрова проведено рандомизированное исследование по оценке эффективности послеоперационной лучевой терапии инвазивного протокового рака молочной железы рТ1-2N0M0 у 317 больных с размерами опухоли до 2,5 см включительно. У подавляющего большинства пациенток (240 из 317) хирургическое вмешательство выполняли в объеме широкой секторальной резекции (77 женщин из 317) или сегментарной резекции, дополненной аксиллярной диссекцией II уровня. Наряду с лучевым лечением больные получали химиотерапию и гормонотерапию.
Лучевую терапию получали 149 женщин, из них у 80 облучена только оставшаяся молочная железа в СОД 50-60 Гр (РОД 2 Гр × 5 раз в неделю), а у 69 лучевому воздействию (СОД 40-50 Гр, РОД 2 Гр × 5 раз в неделю) подвергались и зоны регионарного метастазирования.
В данном исследовании основным фактором, определяющим влияние облучения на отдаленные результаты лечения, оказалась величина опухоли. Как видно из таблицы 2, 5-летняя частота рецидивов при размерах опухоли менее 1 см статистически не различалась и в группе женщин, подвергнутых лучевой терапии, и среди тех, кто ее не получал.
Таблица 3. Частота рецидивов рака молочной железы у больных с размером опухоли
| Тип рецидива | Контроль | Лучевая терапия | р |
|---|---|---|---|
| Рецидив в послеоперационном рубце | 0/51 | 1/40 (2,5%) | >0,05 |
| Рецидив в другом квадранте | 3/51 (5,9%) | 2/40 (5%) | >0,05 |
| Рецидив в молочной железе | 3/51 (5,9%) | 3/40 (7,5%) | >0,05 |
| Рецидив в регионарных лимфатических узлах | 2/51 (3,9%) | 2/40 (5%) | >0,05 |
| Местно-регионарный рецидив | 5/51 (9,8%) | 5/40 (12,5%) | >0,05 |
Совершенно иная картина наблюдалась у больных с опухолями от 1 до 2,5 см включительно. У них послеоперационная лучевая терапия способствовала отчетливому сокращению числа местно-регионарных рецидивов с 9,4% до 1,8% и достоверному (р
| Тип рецидива | Контроль | Лучевая терапия | р | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Рецидив в послеоперационном рубце | 3/117 (2,6%) | 1/109 (0,9%) | >0,05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рецидив в другом квадранте | 5/117 (4,3%) | 0/109 | 0,05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Местно-регионарный рецидив | 11/117 (9,4%) | 2/109 (1,8%) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Время возникновения рецидивов | Число рецидивов |
|---|---|
| До 3 лет | 3 |
| 3-5 лет | 7 |
| 5-11 лет | 10 |
| Всего | 20 |
Изучение зависимости возникновения рецидива от гистогенеза опухоли выявило следующую картину: инвазивный протоковый рак II степени злокачественности – 8, инвазивный протоковый рак III степени злокачественности – 5, комбинированный рак – 2, инвазивный дольковый рак – 2, рак Педжета – 1, слизистый рак – 1, без гистологического определения (IY степень лечебного патоморфоза) – 1 (табл. 6). В 4 случаях неблагоприятными морфологическими признаками прогноза возникновения рецидива были раковые эмболы в сосудах вблизи опухолевого узла, рост инвазивного рака, c-r in situ вблизи опухолевого узла.
Таблица 6. Зависимость частоты рецидивов РМЖ от гистологической формы опухоли.
| Гистологическая форма рака | Число больных | Рецидивы | |
|---|---|---|---|
| абс. | % | ||
| Инвазивный протоковый II степени злокачественности | 214 | 8 | 3,8 |
| Инвазивный протоковый III степени злокачественности | 76 | 5 | 6,6 |
| Инвазивный дольковый | 50 | 2 | 4,0 |
| Инвазивный дольковый в комбинации с инвазивным протоковым | 43 | 2 | 4,6 |
| Другие формы | 55 | 3 | 5,4 |
| Всего | 438 | 20 | 4,6 |
Таблица 7. Рецидивы РМЖ в оставшейся части молочной железы
в зависимости от стадии у больных, не получавших лучевую терапию.
| Стадии РМЖ | Число пациенток | Число рецидивов |
|---|---|---|
| I (Т1N0М0) | 108 | 4 (3,7%) |
| IIА (Т2N0М0, Т1N1М0) | 27 | 4 (14,8%) |
| IIБ (Т2N1М0) | 1 | 1 (100%) |
| Всего | 136 | 9 (6,6%) |
Таблица 8. Рецидивы РМЖ в оставшейся части молочной железы
в зависимости от стадии у больных, получавших лучевую терапию.
| Стадии РМЖ | Число пациенток | Число рецидивов |
|---|---|---|
| I (Т1N0М0) | 73 | 3 (4,1%) |
| IIА (Т2N0М0, Т1N1М0) | 127 | 2 (1,6%) |
| IIБ (Т2N1М0) | 43 | 1 (2,3%) |
| III А (Т1-3N1-2М0) | 50 | 5 (10%) |
| Всего | 293 | 11 (3,8%) |
Самый высокий процент рецидива выявлен при НЕR2-подтипе РМЖ (10%), на 2 месте – трижды-негативный РМЖ (6,1%), на 3 месте – люминальный А подтип (3,1%).
Лечение рецидивов заключалось в следующем: удаление оставшейся части молочной железы – у 14 пациенток, их которых у 5 удаление молочной железы дополнено интраоперационной ФДТ, у 5 – подкожное удаление молочной железы с одномоментной реконструкцией, что связано с возможностью данного вмешательства. Одной пациентке из-за множественных отдаленных метастазов проведена полихимиотерапия.
Таким образом, у 25% больных удалось сохранить молочную железу, увеличив объем операции до подкожной мастэктомии с первичной пластикой аутотканями или в комбинации с эндопротезами. В последующем в данной подгруппе рецидивов не выявлено.
В 4 наблюдениях рецидивы возникли у женщин молодого возраста (до 40 лет), в 16 – после 40 лет (женщин до 40 лет – 34, после 40 лет – 401), т.е. у женщин молодого возраста риск возникновения рецидива высок (11,8%), у женщин более старшего возраста он ниже (3,9%; р<0,05).
С учетом новых данных о подтипах РМЖ и результатов нашего исследования можно рекомендовать не выполнять лучевую терапию после органосохраняющих операций при узловых образованиях 1 см и меньше и при благоприятных морфологических критериях (отсутствие мультицентричности, раковых эмболов по периферии узла и в ткани молочной железы, отсутствие инвазивного протокового рака III степени злокачественности, а также трижды-негативного и НЕR2 подтипа РМЖ).
За 5 лет наблюдений за больными РМЖ, перенесшими органосохраняющее лечение, рецидивы развились у 10 (2,3%) пациенток.
Таким образом, на частоту появления рецидивов влияет стадия РМЖ, молодой возраст пациенток, гистогенез и подтип опухоли. При сочетании неблагоприятных прогностических факторов следует прибегать к реоперации на молочной железе.
Послеоперационное облучение оставшейся части молочной железы не оказало достоверного влияния на частоту рецидива, но время до его возникновения увеличилось на 3-4 года.
При наличии неблагоприятных прогностических факторов лечение должно быть комбинированным и включать все обязательные компоненты для снижения риска рецидивов и отдаленных метастазов.
Несомненно, число органосохраняющих операций должно быть увеличено за счет улучшения диагностики и, как следствие, выявления начальных стадий РМЖ. Выполнять пациенткам при РМЖ I стадии калечащую мастэктомию, когда можно выполнить радикальную резекцию молочной железы, наверное, слишком радикальный метод хирургического лечения.
Выполнение экономных органосохраняющих операций (лампэктомия, туморэктомия) на молочной железе и на лимфатических путях (Д1) возможно только у ограниченного числа больных при I стадии РМЖ и небольшом размере опухолевого узла, поскольку расширение показаний для данных операций приведет к высокому проценту рецидивов, а также увеличению риска появления отдаленных метастазов, и, соответственно, необходимости повторной операции и комплексного лечения.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
- приложение в котором можно создать своего персонажа аниме
- 1000 бонусов в детском мире это сколько рублей

