лиспедрон что это такое
Лиспедрон что это такое
Елена, У нас на хуторе жила бабулька, которая постоянно о чем-то меня расспрашивала, когда видела что я иду в школу или обратно, да и просто в магазин или на почту. Так вот возвращалась я как-то из школы. Классе в 10 училась. И меня соседка спросила сажали ли мы уже цебулю. Я ответила что нет, а когда пришла домой пошла спрашивать у бабушки, что соседка от меня хотела.
Можно жить в одной деревне и не знать их заковыристых полупридуманных слов, особенно если в семье общаются все на нормальном грамотном русском.
Алиса, не, просто там говорили на русском с кое-какими украинскими словами и ещё каким-то вроде языком. Точно не помню. Ну «лиспедрон» или как оно там вероятно выдуманное.
Я к чему это говорю. Типо о значении таких слов когда-то узнаешь в том месте, где проживаешь. И Елена немного не права, говоря, что местный диалект должны знать. Потому что это знание с чего-то должно начинаться. Вот в следующий раз женщина из истории будет знать что это лифчик. Как и я что такое цибуля.
«Омикрон» — вооружен и очень заразен. Чем опасен новый штамм и как его одолеть
Ирина Якутенко
24 ноября Южная Африка официально сообщила, что в стране обнаружен новый штамм коронавируса, который позже получил имя «омикрон». А уже 26-го ВОЗ собрала по его поводу внеочередное заседание. 8 декабря сразу четыре лаборатории подтвердили худшие опасения экспертов: омикрон научился уходить если не ото всех, то от значительной части антител, выработанных после вакцинации или болезни, вызванной предыдущими вариантами SARS-CoV-2. Молекулярный биолог и научный журналист, автор книги о коронавирусе «Вирус, который сломал планету» Ирина Якутенко рассказывает, что означают эти данные, ждет ли нас новая пандемия или, как надеются некоторые, омикрон окажется более мягким коронавирусом, чем его предшественники.
Вирус, который умеет все
«Омикрон» прославился сразу, как только в сети появились первые расшифрованные геномы этого варианта. Внимание вирусологов привлекли его мутации: во-первых, их оказалось очень много — больше 50 значимых изменений (то есть меняющих последовательность не только нуклеотидов в гене, но и аминокислот в кодируемом этим геном белке), из них 30 в гене спайк-белка. Во-вторых, эти мутации выглядели неслучайными: многие из них ученые знали по другим коронавирусным вариантам, где они выполняли вполне конкретные функции. Например, замену N501Y несли варианты альфа, бета и гамма, и, как полагают вирусологи, она помогала им лучше заражать клетки и эффективнее передаваться от одного инфицированного другому. Мутация K417N встречалась у варианта бета и некоторых разновидностей дельты и, видимо, помогала им уходить от части антител. Благодаря замене P681H спайк-белок вируса становится более доступным для разрезания клеточным ферментом фурином — этот шаг необходим коронавирусу для проникновения в клетку. До этого мы видели очень похожую мутацию P681R у дельты и альфы.
Одним словом, «омикрон» собрал в гене своего спайк-белка целый букет изменений, которые помогают лучше прятаться от антител или более эффективно заражать клетки. Но не факт, что все мутации, которые мы видели раньше у других штаммов, у «омикрона» работают так же: белок можно представить себе как запутанный моток шерсти, и каждая аминокислотная замена немного меняет форму этого мотка, причем нередко в какой-нибудь достаточно удаленной его части: изменившаяся форма скопления ниток сдвигает и все остальные части мотка. И когда таких замен оказывается много сразу, итоговая конфигурация может оказаться уже не суммой маленьких изменений, а чем-то совершенно новым. В этой ситуации спайк-белок перестанут узнавать не только антитела, нацеленные на места, где произошли изменения, но и те, которые связывались с другими фрагментами спайка, чья последовательность не поменялась, однако форма стала иной.
Другой момент, отличающий «омикрон» от остальных разновидностей SARS-CoV-2, — его место на эволюционном дереве коронавирусов. Начать с того, что B.1.1.529 (как «омикрон» называется по общепринятой коронавирусной классификации PANGO, основанной как раз на генетическом сходстве вариантов), не является потомком «дельты». Этот факт сам по себе довольно примечателен: в ноябре 2021 года штамм «дельта» был абсолютным гегемоном на планете, вытеснив, благодаря повышенной заразности, все остальные варианты. Максимально логичным сценарием представлялось дальнейшее развитие «дельты» в сторону ухода от антител. Однако «омикрон» произрастает из ветки под названием B.1, которая появилась намного раньше ветки, ведущей к «дельте». И длина «омикроновой» ветви гораздо больше, чем средние длины ветвей между предковыми и потомковыми вариантами. Другими словами, «омикрон» приобрел все свои многочисленные мутации как бы одномоментно. Но в живой природе такого не бывает: изменения всегда происходят постепенно, и внезапное обилие их в одном геноме говорит о том, что «омикрон» долго эволюционировал где-то под радарами, не попадаясь на глаза ученым.
И самое вероятное место скрытой эволюции — организм человека с иммунодефицитом. Иммунная система такого человека не может окончательно избавиться от вируса, но тем не менее постоянно пытается атаковать его. В результате вирус месяцами размножается, причем вирусные частицы, которые все же узнаются антителами, уничтожаются, а выживают те, которые от антител уходят. Встречая новые разновидности вируса, иммунная система адаптирует свои антитела, и цикл отбора повторяется. За множество раундов селекции вирус может набрать огромное количество изменений — и, если такой обновленный вирус перепрыгнет на кого-то еще, для антител новой жертвы этот вариант окажется совершенно незнакомым. А значит, вирус сможет беспрепятственно размножаться так же, как если бы у нового хозяина вовсе не было антител против SARS-CoV-2.
Именно такое развитие событий предположили ученые, впервые увидев геном «омикрона». Но без данных реальных экспериментов все предположения являются всего лишь теориями: даже компьютерные модели не в состоянии достоверно предсказать, как изменятся отношения спайк-белка «омикрона» с антителами с приобретением стольких мутаций. Поэтому первые две недели СМИ и эксперты пытались выяснить, насколько хорошо B.1.1.529 уходит от антител по косвенным данным: скорость распространения и доли привитых среди зараженных.
Неуязвимый
И вот наконец 8 декабря сразу четыре лаборатории представили первые результаты экспериментальной проверки устойчивости «омикрона» к антителам из крови вакцинированных и/или переболевших другими вариантами коронавируса. Первой препринт (то есть статью, которую не смотрели рецензенты и которая пока не опубликована в научном журнале) представила лаборатория Алекса Сигала из Африканского института наук о здоровье (Africa Health Research Institute) в ЮАР. Ученые проводили так называемую реакцию нейтрализации: в подобных экспериментах чувствительные к вирусу клетки заражают им, одновременно добавляя сыворотку крови с антителами. Если антитела хорошо узнают вирусные частицы, сыворотка будет защищать клетки от заражения (нейтрализовать вирус). Так как для эффективной борьбы с вирусом в организме нужно больше антител, чем для нейтрализации in vitro, исследователи добавляют сыворотку в различных разведениях: когда антитела работают, эти разведения могут быть в сотни и тысячи раз. Чем больше можно развести сыворотку при сохранении нейтрализации, тем лучше сработала иммунная система.
Ученые из ЮАР показали, что по сравнению с «дельтой» эффективность нейтрализации «омикрона» антителами из сыворотки вакцинированных меньше в 41 раз. Для людей, которые до или после вакцинации переболели, падение эффективности было чуть менее выраженным, но тоже очень существенным. То есть антитела, выработанные после встречи с вирусами других штаммов или их фрагментами, не видят «омикрон».
Антитела, выработанные после встречи с вирусами других штаммов или их фрагментами, не видят омикрон
В тот же день утром очень похожие результаты выложили немецкие специалисты, работающие под руководством директора института медицинской вирусологии во Франкфурте-на-Майне Сандры Цизек. Сыворотка людей, получивших вторую дозу мРНК-вакцин полгода назад, в принципе не могла нейтрализовать вирус. Через две недели после бустерной дозы эффективность нейтрализации «омикрона» по сравнению с нейтрализацией «дельты» была ниже в 11 раз, через три месяца после бустера — в 37 раз.
В двух других работах ученые также обнаружили снижение эффективности нейтрализации сыворотками вакцинированных, однако меньшее, чем в исследованиях из ЮАР и Германии. В препринте биологов из Каролинского университета в Стокгольме максимальное снижение составило от 1 до 23 раз, а в работе сотрудников компании Pfizer — 25 раз. Разница может объясняться несколькими причинами. Немцы и африканцы работали с живым вирусом, а авторы двух других исследований — с так называемым псевдовирусом. Этим термином называют гибрид, представляющий собой хорошо известный ученым специально ослабленный вирус, в геном которого вставлен ген спайк-белка коронавируса. Псевдовирус синтезирует коронавирусный спайк-белок и выставляет его на своей поверхности. При помощи спайка псевдовирус может цепляться за те же рецепторы, что и настоящий SARS-CoV-2, и заражать клетки.
Псевдовирусные экспериментальные системы очень популярны, так как с псевдовирусом можно работать в обычных условиях, в то время как манипуляции с SARS-CoV-2 разрешены только в лабораториях повышенного класса биологической защиты (BSL-3). Однако такие модели не всегда адекватно отражают реальные процессы, происходящие при заражении. Чтобы доказать, что результаты, полученные на псевдовирусах, можно переносить на реальный вирус, необходимо проводить специальные тесты, которых в случае «омикрона» еще не было. И в любом случае, если B.1.1.529 способен легче заражать клетки благодаря мутациям не в спайке, а в других белках, отловить это, используя псевдовирусы, не получится.
Вторая причина, по которой результат работ отличаются друг от друга, — время, которое прошло с момента вакцинации. Цизек и коллеги работали с сыворотками людей, вакцинированных двумя дозами полгода назад, а сотрудники Pfizer использовали сыворотки людей, получивших вторую прививку три недели назад. Очевидно, во втором случае количество антител будет больше, а значит, нейтрализация окажется более эффективной. Бустер в работе Pfizer добровольцы получили всего за месяц до забора крови, и, как утверждается в пресс-релизе, эти сыворотки были способны нейтрализовать «омикрон» так же хорошо, как сыворотки дважды вакцинированных нейтрализуют «дельту».
Благодаря разному дизайну экспериментов мы можем предварительно заключить, что две дозы вакцины полностью теряют способность нейтрализовать B.1.1.529 в промежутке от трех недель до трех месяцев. Бустер повышает эффективность, однако через три месяца этот эффект также значительно спадает.
Еще одно следствие новых свойств «омикрона» — бесполезность измерения количества антител. Даже для старых штаммов мы не знали, сколько их нужно для хорошей защиты, тем не менее многие пытались выводить границы коридоров эффективности. Теперь всю эту работу придется начинать сначала — и то, только после того, как появятся новые вакцины, адаптированные под «омикрон». На данный момент многие эксперты полагают, что этого шага не избежать, а производители обещают выпустить первые партии обновленных вакцин к марту 2022 года.
Быстрый
Результаты лабораторных экспериментов выглядят очень тревожно, но важно понимать, что снижение эффективности нейтрализации в 40 раз не равно 40-кратному снижению эффективности вакцин. Человек и его иммунная система устроены намного сложнее культуры клеток, поэтому прямо переносить результаты исследований in vitro на людей нельзя. Очевидно, что столь существенное падение эффективности нейтрализации скажется на реальной защите, которую дают вакцины, но для того, чтобы оценить его, необходимо собрать еще и эпидемиологические данные.
Одним из таких необходимых параметров является динамика распространения «омикрона». Исходя из данных об изменении количества положительных тестов в ЮАР, специалисты оценивают прирост новых случаев заражения B.1.1.529 там в 25% в день. И это скорее оценка по нижней границе, так как доля положительных тестов ото всех сделанных тоже растет и уже превысила 26%. Чем больше этот показатель, тем большее количество инфицированных мы пропускаем: когда системы отслеживания налажены хорошо, он находится на уровне нескольких процентов.
Но даже прирост в 25% в день сравним с цифрами, которые мы видели в первую волну, когда коронавирус начал захватывать полностью неиммунную к нему популяцию. Такая прыть «омикрона» может отчасти объясняться его способностью уходить от антител: с точки зрения иммунной системы вакцинированных или переболевших, его спайк-белок — это некое новое образование, против которого антител в организме нет. С другой стороны, нельзя исключать, что «омикрон» сам по себе заразнее «дельты», но для того, чтобы выяснить это, необходимо сравнить скорость распространения двух штаммов в неиммунной популяции, чего мы не можем сделать по объективным причинам.
Другой способ оценить заразность требует статистики по отслеживанию контактов. В Африке она налажена плохо, в Европе после летнего спада тоже, однако системы здравоохранения все же намного лучше умеют решать такого рода задачи. И за пару недель с момента разноса вируса за пределы Африки мы уже видели как минимум один эпизод суперраспространения: в Осло на рождественском обеде больше 70% из сотни гостей заразились от одного человека. Еще один потенциальный случай распространения произошел в Сиднее: по итогам вечеринки на круизной яхте, куда допускали только привитых или переболевших, минимум 5 из 140 гостей заразились «омикроном». Остальные пока находятся на карантине, так что, возможно, число подтвержденных инфекций в итоге окажется больше.
Косвенно оценить собственную заразность B.1.1.529 можно также в экспериментах по заражению животных, но на проведения и анализ результатов таких опытов потребуется время.
Как бы то ни было, сегодня мы видим, что «омикрон» не сильно уступает «дельте» по скорости распространения (хотя статистики пока мало, все выводы нужно делать с осторожностью). И теперь основной вопрос связан с течением вызванного этим штаммом заболевания. Уход от антител не означает, что вакцины будут намного хуже предотвращать тяжелое течение. Антитела представляют собой только первый бастион иммунной защиты, их роль — предотвратить заражение клеток. Но если оно уже случилось, в игру вступают Т-клетки, задача которых — уничтожить все, что инфицировано. Вакцины и перенесенная болезнь стимулируют образование не только антител, но и Т-клеток, причем эта ветвь иммунитета более устойчива к мутациям.
Возможно, менее опасный для вакцинированных
Огромная статистика по привитым показывает, что даже после прихода «дельты» защита от тяжелого течения у вакцинированных остается на уровне 90%, хотя защита от заражения и упала. По сравнению с предковыми штаммами последовательности спайк-белка, которые узнаются Т-клетками (они реагируют на небольшие линейные фрагменты), у «альфа»- и «дельта»-штаммов изменялись примерно на 10%. В случае омикрона возможные изменения оцениваются в пределах 20–30%. То есть можно ожидать, что Т-клетки, выработанные против предыдущих вариантов SARS-CoV-2 сохранят неплохую активность и в отношении «омикрона».
Пока однозначно сказать, действительно ли у людей, имеющих Т-клетки против других версий коронавируса, сохраняется защита от тяжелых симптомов, сложно. В первые дни количество госпитализаций в ЮАР не увеличивалось или увеличивалось очень медленно, но сейчас этот показатель существенно вырос, как выросло и количество людей, которым требуется искусственная вентиляция легких. Постепенно сдвигается и возрастной состав: с каждым днем в больницах увеличивается количество пожилых людей. Это ожидаемый процесс, если предположить, что патогенез «омикрона» сходен с патогенезом «дельты»: люди старшего возраста и те, у кого есть хронические заболевания, с большей вероятностью болеют тяжело, в том числе иногда и после вакцинации. Их организм не в состоянии как следует бороться с вирусом, и даже помощь в виде двух или трех доз вакцины может оказаться недостаточной.
Еще один тревожащий фактор — высокий процент среди госпитализированных маленьких детей. Эта когорта в Африке практически на 100% невакцинирована, и необычная представленность детей среди пациентов с тяжелыми симптомами может указывать на то, что в чистом виде без страховки антителами и Т-клетками «омикрон» может быть опасен. Впрочем, для однозначных выводов необходимо дождаться лучшей статистики, нельзя исключать, что большое число детей — артефакт первых недель распространения нового штамма и повышенного внимания к любым проявлениям болезни.
Но кое-что про «омикрон» уже можно сказать однозначно: по итогам лабораторных экспериментов немецкие вирусологи выяснили, что он стал невидимым для обоих моноклональных антител, входящих в коктейль от компании Regeneron. Моноклональные антитела — это препарат, который вводят внутривенно на ранних стадиях болезни. Он представляет собой несколько сверхвысокоэффективных антител против коронавируса, искусственно синтезированных в лаборатории. Обычно моноклональные антитела назначают пациентам из групп риска, которые, с высокой вероятностью, не смогут полноценно выработать собственный иммунный ответ. Они в несколько раз снижали риск плохих исходов, но против «омикрона» коктейль, действовавший в отношении других штаммов, видимо, бесполезен. Хорошая новость в том, что два других препарата для раннего вмешательства — молнупиравир от компании Merck и паксловид, выпускаемый Pfizer, — скорее всего, сохранят эффективность, так как их активность не связана со спайк-белком.
Что нужно знать о вакцине «ЭпиВакКорона»
Когда я записываюсь на вакцинацию на портале госуслуг, можно выбрать, какой вакциной меня будут прививать?
Решение о том, какой вакциной прививаться, должно приниматься по рекомендации врача. Важно правильно проинформировать доктора, особенно если вы знаете, что у вас есть хронические недуги, принадлежность к группе риска, аллергические реакции.
Идеальный вариант, когда в прививочном кабинете у врача есть выбор вакцин, и он может на основании возраста пациента, данных о сопутствующих заболеваниях и аллергического анамнеза сделать выбор в пользу того или иного препарата. Сейчас пока, к сожалению, выбора у многих специалистов нет, потому что широкие поставки «ЭпиВакКороны» и третьей нашей вакцины «КовиВак» от Центра имени Чумакова только начинаются. Поэтому врач решает, подходит ли человеку та вакцина, которая в настоящее время есть в наличии, или рекомендует отложить прививку, подождать другой препарат. К лету все три вакцины будут суммарно производиться в объеме 20-25 миллионов доз ежемесячно. Тогда появится реальный выбор.
Если человек переболел COVID-19, он получает иммунитет к заболеванию. Может, лучше переболеть, чем прививаться?
После перенесенного заболевания иммунитет такой же, как и после вакцинации. Но дело в том, что не стоит так рисковать. Даже молодые люди порой болеют COVID-19 очень тяжело, не говоря уже о пожилых, у которых есть сопутствующие заболевания.
С другой стороны, сейчас все больше набирается данных о постковидном синдроме, причем даже у тех, кто болел легко. Некоторые пациенты уже более полугода отмечают симптомы, которые говорят о нарушениях в работе нервной системы, у них остаются проблемы с психоэмоциональной сферой, люди жалуются на выпадение волос, что особенно неприятно для женщин. Это уже не говоря о последствиях для легких, сердца, других жизненно важных органов. Поэтому лучше не экспериментировать, не рисковать здоровьем, а привиться.
Надо помнить, что далеко не всегда иммунитет, приобретенный в результате болезни, защищает от повторного заражения. Мы наблюдаем случаи, когда люди, особенно в возрасте, второй раз болеют гораздо тяжелее.
В чем преимущество иммунитета, приобретенного после вакцинации?
Даже если вдруг вы относитесь к тому незначительному числу людей, у которых поствакцинальный иммунитет будет не стопроцентно защитный, и случится так, что вы все же заразитесь, вы гарантированно не умрете. У привитых заболевание протекает намного легче. Это такая же ситуация, как с гриппом.
Я переболел COVID-19 в легкой форме. Я могу привиться сейчас или лучше отложить?
Как часто нужно проверять уровень антител после перенесенного COVID-19?
После подтвержденного заболевания целесообразно проверить уровень антител примерно через полгода. Не имеет смысла это делать чаще, как бы ни агитировали некоторые частные лаборатории за частый скрининг.
Можете назвать преимущества вакцины «ЭпиВакКорона»?
По данным центра «Вектор», у 20 тысяч людей, которые уже привиты этой вакциной, только у нескольких человек, буквально единичные случаи, наблюдалась небольшая гиперемия (отечность) в месте инъекции. Эта вакцина имеет такой состав, что очень мягко действует на иммунную систему, не перегружает ее.
Нельзя прививаться, если у вас сейчас какое-то острое заболевание либо обострение хронического. Онкобольным нужно обязательно проконсультироваться с онкологом.
Какое время нужно выдержать после стабилизации состояния, чтобы можно было делать прививку?
Если человек сделал первую прививку, но заразился коронавирусом, ему нужно прививаться после выздоровления?
Самое дорогостоящее лекарство в мире
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Не так давно, в мае 2019 года, произошло знаковое событие в сфере лечения генетических заболеваний: Управление по санитарному надзору за качеством продуктов и медикаментов США (FDA) одобрило препарат Zolgensma («Золгенсма», или онасемноген абепарвовек). Это лекарственное средство предназначено для генотерапевтического лечения спинально-мышечной атрофии (СМА). Сегодня «Золгенсма» является самым дорогим лекарственным препаратом в мире.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Что такое СМА?
Спинально-мышечной атрофией, или СМА, называют смертельно опасное нейродегенеративное заболевание, в процессе развития которого у пациента происходит постепенная атрофия скелетной мускулатуры. В результате человек теряет или так и не приобретает способности ходить, самостоятельно стоять, сидеть без поддержки. Со временем возникает сколиоз и другие ортопедические проблемы. Также СМА-пациенты, если они не получают должного ухода и лечения, постепенно утрачивают способность самостоятельно дышать, глотать, кашлять. Пациенты с первым, самым тяжелым, типом СМА еще несколько лет назад, как правило, не доживали и до двух лет [1].
СМА возникает из-за потери участка хромосомы или точечной мутации гена SMN1, расположенного в пятой хромосоме. В результате этого нарушается синтез SMN-белка, недостаток которого приводит к гибели моторных нейронов и атрофии скелетной мускулатуры [2].
Для того чтобы болезнь проявилась, носителем рецессивной мутации в гене SMN1 должны быть оба родителя. Примерно каждый 40-й житель Земли является таким носителем.
Подробнее о причинах возникновения, диагностике, течении спинально-мышечной атрофии читайте в статье «Надежда для СМАйликов» [3].
Терапия спинально-мышечной атрофии до появления «Золгенсмы»
До недавнего времени методы лечения СМА сводились к поддерживающей терапии. Больным рекомендовали специальное питание, витамины, умеренные физические нагрузки, при необходимости — хирургическое вмешательство, искусственная вентиляция легких. К сожалению, до сих пор значительная часть СМА-пациентов получает лишь такое лечение.
Рисунок 1. «Спинраза» — первый препарат, одобренный для лечения СМА
С 2016 года сначала в США, а затем и в Европе для лечения спинально-мышечной атрофии стали применять препарат «Спинраза» (нусинерсен) [4]. Он позволяет существенно увеличить продукцию полноценного SMN-белка, что ведет к сглаживанию симптомов заболевания. Терапия тем эффективнее, чем меньше возраст пациента.
Стоимость препарата составляет несколько сот тысяч долларов в год, поэтому его закупка осуществляется не за счет пациента. Одна за другой страны разных континентов одобрили препарат и стали применять для спасения жизней своих сограждан. В некоторых государствах этот процесс сильно затянулся из-за бюрократических проволочек и нехватки финансирования.
В РФ «Спинразу» Минздрав одобрил в начале 2019. В свою очередь компания «Биоген», производитель «Спинразы», в апреле 2019 г. объявила об открытии в России «Программы расширенного доступа» для лечения СМА нусинерсеном. Благодаря этой программе доступ к препарату получили 40 детей из России, страдающих СМА I типа [5].
В августе «Спинраза» была включена в Государственный реестр лекарственных средств РФ. Однако охват больных все еще слишком мал. В Российской Федерации зарегистрировано около 800 СМА-пациентов, и далеко не все они получают инъекции «Спинразы».
Отличия «Золгенсмы» от «Спинразы»
После появления на фармацевтическом рынке «Спинразы» все ждали выхода принципиально нового препарата для лечения СМА, основанного на генотерапевтическом подходе. Лидером в данной разработке оказалась компания «Новартис» (Novartis), которая в 2018 году купила компанию «Авексис» (AveXis) за 8,7 млрд долларов, а в 2019 вышла на рынок c препаратом «Золгенсма» (Zolgensma, он же AVXS-101, или онасемноген абепарвовек) [6].
Рисунок 2. Логотип препарата «Золгенсма»
Чем же «Золгенсма» принципиально отличается от препарата «Спинраза»? Самое важное различие заключается в механизме действия: «Спинраза» исправляет дефект сплайсинга матричной РНК гена SMN2, но она никак не затрагивает ген SMN1, мутации в котором и являются основной причиной развития спинально-мышечной атрофии.
Действие же препарата «Золгенсма» направлено именно на ген SMN1. Благодаря использованию этого лекарственного средства, мутировавший или отсутствующий ген SMN1 замещается функционально полноценным геном [1].
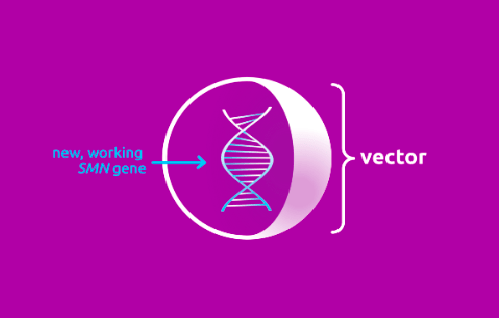
Происходит это следующим образом: препарат содержит функционально полноценный ген SMN1, который находится внутри вектора. Задача вектора — быстро доставить его в мотонейроны тела (рис. 3).
Рисунок 3. Условное изображение вектора, входящего в состав «Золгенсмы»
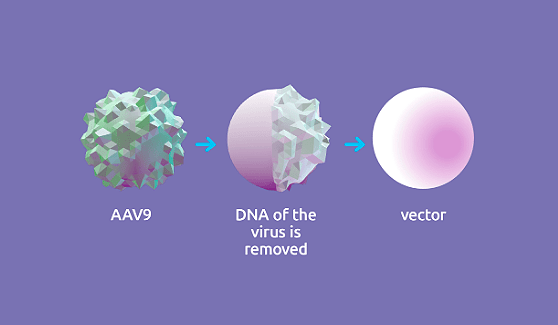
Для создания вектора использовали аденоассоциированный вирус (adeno-associative virus 9, или AAV9). Это представитель семейства парвовирусов, который способен инфицировать клетки человека и других приматов, но при этом не является патогенным. Все это делает AAV9 отличным генетическим вектором. Собственный генетический материал вируса удалили и вместо него поместили функционально полноценный ген SMN1 (рис. 4).
Рисунок 4. Условная схема механизма создания вектора
После того, как ген прибывает в нужную локацию, вектор разрушается и выводится из организма.
СМА-пациенту необходима всего одна инфузия препарата «Золгенсма» в течение жизни, в то время как лечение «Спинразой» требует нескольких доз в год. Отсюда и стоимость «Золгенсмы»: 2 125 000 долл. США. Такая ценовая политика компании-производителя делает данный препарат самым дорогим лекарственным средством на сегодняшний день. Для сравнения, стоимость все той же «Спинразы» составляет 125 тыс. долларов за одну дозу. При этом в первый год лечения нужно шесть инфузий, в последующие периоды — три инфузии ежегодно.
Насколько оправдана такая цена препарата и какова же его себестоимость? «Новартис» не афиширует информацию относительно себестоимости «Золгенсмы», поэтому эксперты оценивают стоимость препарата по двум показателям: качество жизни пациента с учетом прожитых лет (QALY) и добавленные годы жизни (LYG). По данным Института клинико-экономической экспертизы (Institute for Clinical and Economic Review, ICER), исходя из показателя QALY стоимость «Золгенсмы» должна быть в пределах 1,1–1,9 миллионов долл. США; исходя из показателя LYG — 1,2–2,1 миллиона долл. США. Таким образом, можно сказать, что стоимость «Золгенсмы» завышена по отношению к оценкам экспертов [7].
При формировании своей ценовой политики компания «Новартис» отталкивалась от стоимости препарата «Спинраза». По задумке производителя в течение десяти лет на лечение СМА-пациента «Спинразой» необходимо будет потратить более 4 млн долларов, в то время как одна инфузия «Золгенсмы» стоит 2 млн 125 тысяч. Таким образом, в долгосрочной перспективе второй вариант более выгоден [8], [9].
Компания «Новартис» ожидала, что «Золгенсма» станет «блокбастером», то есть принесет более 1 млрд долларов за первый год продаж. Однако скандал, который возник вокруг «Золгенсмы», может не дать осуществиться этим планам. Летом 2019 г. компания «Новартис» сама сообщила FDA о манипуляции с данными при проведении тестирования препарата на животных. Если бы эти данные были известны FDA в мае, то разрешение на использование препарата «Золгенсма» «Новартис» получила бы позже, но сейчас принято решение не отзывать препарат [10].
Сумму в два с лишним миллиона долларов не в состоянии заплатить большинство СМА-семей, поэтому предполагается, что пациенты будут обеспечиваться жизненно важным лечением благодаря государственной поддержке или за счет страховых компаний. Кроме того, производитель «Золгенсмы» предоставляет пятилетнюю рассрочку на оплату генной терапии и дает возможность пациенту не выплачивать оставшуюся сумму, если препарат перестанет действовать [8]. Сегодня препарат «Золгенсма» доступен только для жителей США, так как FDA — это единственная организация, которая его одобрила. Также есть ограничения по возрасту и тяжести заболевания: пока препарат применяется только для пациентов до двух лет с первым типом СМА. В дальнейшем производитель планирует использовать препарат и для других групп людей, страдающих спинально-мышечной атрофией.
Важно также отметить, что «Золгенсма» вводится внутривенно. «Спинраза» же должна попасть в спинномозговую жидкость пациента, что создает ряд дополнительных проблем и рисков.
Побочные эффекты «Золгенсмы»
Кроме высокой стоимости, у «Золгенсмы» есть и другие серьезные недостатки. Возможными побочными эффектами препарата являются:
Не рекомендуется использование «Золгенсмы» у недоношенных детей до достижения ими полного гестационного возраста.
По данным компании-производителя на момент регистрации «Золгенсма» в рамках клинических исследований была применена для терапии 44 детей в возрасте от 0,3 до 7,9 месяцев с массой тела от 3 до 8,4 кг. Такая небольшая выборка объясняется тем, что СМА является редким заболеванием, поэтому набрать большое количество пациентов за короткий период времени — не такая уж и простая задача.
С другой стороны, небольшая выборка означает, что количество побочных эффектов препарата может быть значительно выше, чем известно на данный момент. Так, производитель уведомляет, что один из СМА-пациентов, который участвовал в клинических исследованиях за пределами США, через 12 дней после инфузии препарата начал страдать от дыхательной недостаточности. Также у него были зафиксированы лейкоэнцефалопатия, приступы гипотензии и судорог примерно через месяц после начала лечения. Через 52 дня наступил летальный исход. Но пока сложно сказать, является ли подобное развитие событий реакцией на введение препарата или же эти симптомы появились бы у СМА-пациента и без использования «Золгенсмы».
Важно также отметить, что долгосрочное влияние препарата на организм человека пока неизвестно. Прежде всего, не ясно, будет ли экспрессия гена SMN1 в организме пациента поддерживаться постоянно или постепенно сойдет на нет. Чтобы ответить на этот вопрос, «Новартис» обязана постоянно собирать данные долговременного наблюдения. В разрезе стоимости это является ключевым риском для плательщиков. Компания-производитель пытается снизить эти риски, предлагая рассрочку на пять лет пациентам, с правом приостановить выплаты, если препарат не будет проявлять своего терапевтического действия. Однако если экспрессия гена прекратится после истечения пятилетнего срока, то никакой финансовой компенсации за это не предусмотрено.
Следующий шаг
Компания-производитель «Золгенсмы» планирует в будущем применять препарат для пациентов разных возрастов со СМА II и III типов. Также «Новартис» работает над регистрацией препарата за пределами США.
Рисунок 5. Рисдиплам — препарат для лечения спинально-мышечной атрофии, который находится на стадии клинических испытаний на людях
Появление «Золгенсмы» на фармакологическом рынке повлияло на продажи «Спинразы», поэтому компания «Биоген» уже проводит клинические исследования, направленные на усиление терапевтической активности «Спинразы» путем увеличения ее дозы [11].
Но «Спинраза» и «Золгенсма», возможно, недолго будут единственными препаратами для лечения спинально-мышечной атрофии. Компания «Рош» (Roche) уже достаточно давно ведет клинические испытания своего лекарственного средства (рисдиплама) и, по всей видимости, в ближайшие пару лет данный препарат также выйдет на фармацевтический рынок (рис. 5).
Рисдиплам, как и нусинерсен («Спинраза»), не влияет на ген SMN1, а модифицирует сплайсинг мРНК гена SMN2. Однако у рисдиплама есть существенное отличие: препарат принимается перорально и не требует введения в спинно-мозговую жидкость. Кроме того, рисдиплам подходит для всех типов СМА и в клинических испытаниях показывает более высокую эффективность, чем нусинерсен [12].
По прогнозам экспертов, цена препарата будет значительно ниже, чем «Спинразы» и «Золгенсмы», поэтому новое средство сможет составить серьезную конкуренцию уже существующим лекарствам [8].
Уже в конце 2019 года компания Roche планирует подать документы на одобрение препарата в FDA и EMA (Европейское медицинское агентство) [13].
Сегодня «Золгенсма» является одним из немногих одобренных генотерапевтических препаратов, и единственный — для лечения СМА. Данная технология является чрезвычайно перспективной и теоретически может подарить шанс СМА-пациентам на продолжительную жизнь высокого качества. Однако возможные побочные эффекты и высокая стоимость препарата пока не позволяют делать поспешных радужных выводов.