лимфома цнс что это такое
Лимфома цнс что это такое
Первичные лимфомы головного и спинного мозга развиваются редко. Обычно ЦНС поражается наряду с другими структурами в результате распространения опухоли. Поражение ЦНС характерно для диффузных Т-клеточных лимфом, особенно в детском возрасте, и обычно оно развивается на фоне пораженного костного мозга.
Первичная лимфома головного мозга
Первичная лимфома головного мозга довольно редкая опухоль, которая чаще развивается у больных СПИДом, после пересадки почки и у больных, длительное время получавших иммунодепрессанты.
Обычно опухоль представляет собой агрессивную лимфому, состоящую из центроцитарных, центробластных и лимфоплазмоцитарных клеточных элементов. Опухоли развиваются в большом мозге (70%), мозжечке и стволе мозга (25%), и реже в позвоночнике.
Лимфома растет как мультицентрическая и обычно инфильтрирует периваскулярные зоны. У больных наблюдаются признаки и симптомы, типичные для мозговых опухолей. Хотя в позвоночнике опухоли развиваются редко, на поздних стадиях заболевания наступает инфильтрация спинномозговой жидкости клетками опухоли. К числу редких осложнений относится миграция опухолевых клеток в стекловидное тело глаза, сопровождающееся потерей зрения.
Обычно, при первичном осмотре, у больных не обнаруживается признаков развития лимфом, локализованных в других органах. Также они не развиваются и в более поздние сроки. Для установления стадии развития опухоли проводят исследование костного мозга и спинномозговой жидкости.
Если пациент не болен СПИДом, то можно назначить курс лучевой терапии. Однако рост опухоли с трудом поддается контролю, и обычно даже после облучения в дозах 45-50 Гр часто наблюдаются локальные рецидивы.
В настоящее время, назначают лекарственное лечение без лучевой терапии или перед облучением. В состав рецептуры входят высокие дозы метотрексата, цитозинарабинозида, и алкилирующих агентов, проникающих через гематоэнцефалический барьер (нитрозомочевины, прокарбазин и темозоламид).
В настоящее время хорошо разработаны основные принципы лучевой терапии лимфом головного мозга. Неблагоприятный прогноз характерен для больных старше 60 лет. Лечение оказывается результативным у 60-80%) больных (в зависимости от критерия оценки эффективности), при средней выживаемости 50 месяцев.
При лечении развиваются токсические осложнения, особенно, если в комплекс лечебных мероприятий включают лучевую терапию. Если в спинномозговой жидкости обнаруживаются опухолевые клетки, болезнь с трудом поддается лечению даже при использовании химиотерапии и облучения.
С началом распространения СПИДа лимфому ЦНС стали рассматривать как опухоль, сопутствующую этому заболеванию. Опухоль представляет собой агрессивное В-клеточное новообразование, обычно развивающееся у тяжелобольных СПИДом (многие случаи диагносцируются при посмертном вскрытии).
При обследовании у больных обнаруживаются неврологические патологии местного характера, паралич черепного нерва, обмороки и расстройства психики. При КТ бывает трудно установить границы опухоли, и характер повреждений затрудняет ее дифференциальную диагностику с токсоплазмозом. Лечение этих опухолей сложно и малоэффективно. Больные очень ослаблены, и их иммунитет полностью нарушен. При локализованной опухоли может помочь лучевая терапия. При химиотерапии возрастает вероятность развития посторонних инфекций, и поэтому ее следует назначать с осторожностью.
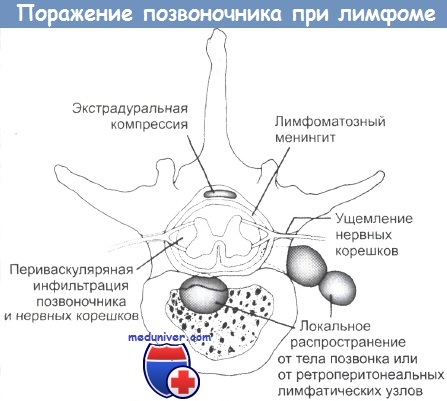
Экстрадуральная компрессия может происходить в результате поражения тела позвонка или распространения опухоли от парааортальных лимфатических узлов.
Лептомснинтеальная инфильтрация, вероятно, имеет гематогенную природу и особенно часто происходит при поражении костного мозга.
Вторичная лимфома центральной нервной системы
В 9% всех случаев НХЛ происходит поражение ЦНС. Клинически это проявляется или как лимфоматозный менингит (55%), или как экстрадуральная компрессия (45%). У большинства больных первичная опухоль развивается в виде диффузной крупноклеточной (центробластной) или диффузной центроцитарной лимфом. В 70% случаев при микроскопичесом исследовании в ходе первичного осмотра обнаруживается поражение костного мозга. При применении более чувствительных методов эта цифра может оказаться еще больше.
Обычно к моменту постановки диагноза лимфатические узлы оказываются пораженными, особенно это относится к ретроперитонеальным узлам. Поражение ЦНС при лимфомах очень характерно для детского возраста и чаще наблюдается при Т-клеточных опухолях.
Клинически лимфоматозный менингит проявляется как паралич черепного нерва; для него также характерны психические расстройства и возрастание внутричерепного давления. Из-за сдавления и периваскулярной инфильтрации опухолью часто наблюдаются повреждения корешков нервов. Проводят исследование спинномозговой жидкости и, если возможно, определяют поверхностные маркеры (укороченная легкая цепь, маркеры Т-клеток).
Этот этап дифференциальной диагностики необходим для того, чтобы отличить клетки опухоли от реактивных лимфоцитов, которые обнаруживаются при туберкулезе или при грибковом менингите.
Эпидуральная компрессия обычно развивается в грудном отделе позвоночника, однако нервные корешки, включая cauda equina (конский хвост), могут подвергаться сдавлению. У таких больных лимфома располагается в заднебрюшинной области и иногда поражает позвонки. При этом развивается парапарез, и требуется оказание срочной помощи.
Лимфоматозный менингит представляет собой серьезное осложнение лимфомы, и вылечиваются лишь немногие больные. Для лечения назначают метотрексат (интратекально) в комбинации с цитозинарабинозидом и облучением области головы и позвоночника. Больным с высоким риском поражения ЦНС (детские лимфомы и Т-клеточные лимфомы детского и юношеского возраста) необходимо профилактическое лечение ЦНС с назначением метотрексата и облучением области головы.
Это помогает избежать поражения ЦНС. У взрослых поражение ЦНС наблюдается реже. При системном лечении часто используют рецептуры, которые содержат препараты, попадающие в спинномозговую жидкость и поэтому являющиеся более эффективными. Наоборот, риск поражения нервной системы у взрослых может быть меньше, чем считалось до сих пор.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Первичная лимфома центральной нервной системы у взрослых. Клинические рекомендации.
Первичная лимфома центральной нервной системы у взрослых
Оглавление
Ключевые слова
Первичная лимфома центральной нервной системы,
Список сокращений
ВДХТ – высокодозная химиотерапия
ВИЧ – вирус иммунодефицита человека
ГЭБ – гемато-энцефалический барьер
КТ – компьютерная томография
ЛТ – лучевая терапия
МРТ – магнитно-резонансная томография
ПЭТ – позитронно-эмиссионная томография
СМЖ – спинномозговая жидкость
Термины и определения
Первичная лимфома центральной нервной системы (ПЛЦНС) – это одна из самых агрессивных экстранодальных лимфом, которая может поражать все структуры центральной нервной системы (ЦНС), в том числе заднюю стенку глаза.
Посттерапевтическая нейротоксичность – лейкоэнцефалопатия, проявляющаяся когнитивными нарушениями, а также такими серьезными нарушениями, как слабоумие, нарушения походки и недержание мочи.
1. Краткая информация
1.1 Определение
Первичная лимфома центральной нервной системы (ПЛЦНС) – это одна из самых агрессивных экстранодальных лимфом, которая может поражать все структуры центральной нервной системы (ЦНС), в том числе заднюю стенку глаза [1].
1.2 Этиология и патогенез
Патогенез ПЛЦНС является спорным. Некоторые исследования показывают, что распространение злокачественного клона может произойти среди нормальных B-лимфоцитов, расположенных в ЦНС, теория поддерживается доказательством возникновения лимфомы в белом веществе головного мозга. Другая теория: клон злокачественных лимфоцитов при помощи специальных молекул адгезии может путешествовать и проникнуть в ЦНС [1].
1.3 Эпидемиология
Первичная лимфома ЦНС (ПЛЦНС) является редким заболеванием. Она определяется как поражение паренхимы головного или спинного мозга, оболочек мозга, глаза, без признаков системного заболевания.
Частота встречаемости ПЛЦНС за последние два десятилетия возросла в 7?10 раз, как у людей с иммунодефицитом, так и без него. На первичную лимфому ЦНС приходится около 4-7% от всех первичных опухолей головного мозга, 2-3% от всех неходжкинских лимфом и 4-6% от всех экстранодальных лимфом. Медиана возраста больных – 60-65 лет [22].
Наиболее часто ПЛЦНС поражают больных с ослабленным иммунитетом: так, ПЛЦНС составляют 20% от всех ВИЧ-ассоциированных лимфом [17, 18]. До начала применения антиретровирусной терапии (АРТ), число случаев возникновения ПЛЦНС у ВИЧ-инфицированных лиц постоянно росло. Однако, влияя на количество CD4-клеток, может снижать частоту возникновения ПЛЦНС, поскольку вероятность её возникновения обратно пропорциональна числу CD4-клеток [1,2].
1.4 Кодирование по МКБ 10
С81-С88 (локализация в ЦНС).
1.5 Классификация
Чаще первичные лимфомы головного мозга представлены одиночными или множественными внутримозговыми узлами, которые локализуются в лобной доле (приблизительно в 50% случаев), в мозолистом теле и глубинных структурах мозга (приблизительно в 40% случаев). В 35% случаев отмечается мультифокальный рост объемного образования. Значительно реже встречаются лептоменингеальный вариант (16%) и поражение спинного мозга ( 0.3;
Поиск в электронных базах данных.
Базы данных, использованных для сбора / селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
Обзоры опубликованных мета-анализов;
Систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
Оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл.4,5).
В настоящих клинических рекомендациях в квадратных скобках приведены уровни доказательности рекомендаций, в соответствии со шкалами, разработанными Американским обществом клинической онкологии (ASCO) и Европейским обществом медицинской онкологии (ESMO).
Таблица П1 Уровни доказательности
Как минимум одно крупное рандомизированное контролируемое исследование высокого качества (с низкой вороятностью ошибок) или мета-анализ гомогенных рандомизированных исследований высокого качества
Неблольшие рандомизированные исследования или крупные рандомизированные исследования с высокой вероятностью ошибок. Мета-анализ подобных исследований или мета-анализ гетерогенных исследований
Проспективные когортные исследования
Ретроспективные когортные исследования или исследования «случай-контроль»
Исследования без контрольной группы, отдельные случаи, мнение экспертов
Таблица П2 Степени доказательности
Достоверные данные о высокой клинической эффективности, настоятельно рекомендуется
Достоверные или убедительные данные об умеренной клинической эффективности, рекомендуется
Недостоверные данные об эффективности, которая не перевешивает риск или недостатки лечения (нежелательные явления, стоимость и т.д.), может применяться как один из вариантов
Индикаторы доброкачественной клинической практики (Good Practice Points – GPPs):
Доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
Методология валидизации рекомендаций
Методы валидизации рекомендаций:
Внешняя экспертная оценка;
Внутренняя экспертная оценка.
Описание методики валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных Федеральных центров РФ и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях рабочей группы в 2015-2016 гг., на Форуме экспертов по вопросам диагностики и лечения злокачественных лимфопролиферативных заболеваний «Лимфорум», ежегодной Российской конференции с международным участием «Злокачественные лимфомы», а также III Конгресса гематологов России.
Окончательная редакция:
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Клинические рекомендации утверждены на XIII Российской конференции с международным участием «Злокачественные лимфомы» в 2016.
Приложение Б. Алгоритмы ведения пациента
Приложение В. Информация для пациентов
Пациент должен четко выполнять все предписания врача относительно времени и сроков выполнения диагностических процедур, а также курсов химиотерапии. Обязательно должен сообщить о нежелательных явлениях, если таковые имеются, во время прохождения лечения.
Лимфома
Что такое лимфома?
Лимфома – это поражение иммунной системы и внутренних органов, в которых скапливаются измененные клетки, нарушающие работу тканей.
Опухоль развивается в лимфатической системе, которая помогает нам бороться с инфекциями и другими заболеваниями. Циркулирующая в ней лимфа омывает все клетки организма и доставляет в них необходимые вещества, забирая отходы. В расположенных по всей ее сети лимфатических узлах опасные вещества обезвреживаются и выводятся из организма.
Лимфосистема дополняет кровеносную и помогает жидкостям перемещаться по телу. В отличие от крови, скорость движения которой задает «насос» – сердце, лимфа медленно циркулирует самостоятельно.
Как развивается лимфома?
Онкология начинается с появления в организме всего лишь одной измененной клетки иммунной системы. Всего выделяют 2 основных их типа:
Почти все ненормальные клетки выявляются и уничтожаются нашим иммунитетом, но некоторым из них удается выжить. Они постепенно размножаются, распространяются по всему телу, создают опухоли, скапливаются во внутренних органах и нарушают их работу.
Заболевание может возникать в любой области, где находится лимфатическая ткань, основными участками которой являются:
Лимфома – это рак?
Раком официальная медицина России и некоторых других стран называет злокачественные опухоли – опасные для жизни новообразования, которые развиваются в эпителиальных клетках, содержащихся в коже или слизистых оболочках, и выстилающих внутреннюю поверхность органов.
Лимфома – это не рак, а онкологическое заболевание. Она образуется из лимфоцитов, а ее клетки также умеют бесконтрольно делиться, накапливаться в тканях, нарушая их работу, и создавать дополнительные очаги заболевания в различных частях тела.
Типы лимфом
Врачи выделяют 2 их основных класса:
Лимфома Ходжкина, или лимфогранулематоз: чаще всего начинается в лимфатических узлах верхней части тела – на груди, шее или в подмышках. Как правило, она распространяется в различные лимфоузлы по лимфатическим сосудам, но в редких случаях на поздних стадиях проникает в кровоток и распространяется на другие части тела, такие как печень, легкие или костный мозг. Данный диагноз ставится при выявлении в организме особых клеток – Березовского-Рид-Штернберга, которые представляют из себя измененные В-лимфоциты.
К неходжкинским лимфомам относят все остальные типы заболевания – их насчитывается около 30. У каждого из них есть свои, особые признаки: расположение первичной опухоли, строение и скорость развития.
Причины развития лимфом
Врачам и ученым точно не известно, почему именно в организме человека начинает развиваться заболевание. Они знают лишь о факторах, которые повышают вероятность образования каждого из типов онкологии.
Для лимфом Ходжкина они выглядят следующим образом:
Список таких факторов для неходжкинских лимфом выглядит иначе:
Симптомы и признаки лимфомы
Как правило, на ранних этапах данный тип онкологии никак себя не проявляет, а ее обладатель хорошо себя чувствует и не подозревает о болезни – почти все ее симптомы появляются позже, на запущенных стадиях.
Один из наиболее частых признаков – появление припухлости на шее, в подмышках, паху или над ключицей, которая представляет из себя увеличенный лимфатический узел. Обычно такое новообразование не болит, но со временем нередко увеличивается, а рядом с ним или в других областях тела появляются новые шишки.
Лимфомы, которые начинают развиваться или разрастаются в брюшной полости, способны вызвать отек или боль в животе, тошноту и рвоту. Такие ощущения возникают из-за укрупнения лимфоузлов или внутренних органов, таких как селезенка или печень, либо скопления большого количества жидкости.
Изменившаяся в размерах селезенка может давить на желудок, вызывая потерю аппетита и чувство сытости после небольшого количества пищи.
Увеличившиеся тимус Тимус, или вилочковая железа – небольшой орган, расположенный за верхней частью грудины перед сердцем. В нем происходит созревание и развитие некоторых лимфоцитов. или лимфоузлы грудной клетки могут оказывать давление на трахею, по которой воздух проходит в легкие. Это приводит к появлению кашля, затруднению дыхания, болевым ощущениям или тяжести в груди.
Поражения головного мозга способны вызывать головную боль, слабость, изменение личности, проблемы с мышлением и судороги.
Другие типы заболевания могут распространяться на окружающие головной и спинной мозг ткани, из-за чего у пациента двоится в глазах, немеет лицо и ухудшается речь.
Лимфомы кожи часто проявляются в виде зудящих красных бугорков или шишек.
Кроме того, симптомами могут быть:
Диагностика лимфомы
Большинство пациентов обращаются к врачу из-за наличия определенных признаков заболевания или плохого самочувствия.
Специалисты начинают обследование с осмотра и опроса – о семейных диагнозах, возможных факторах риска и других проблемах со здоровьем. Затем изучают лимфатические узлы и другие части тела, в которых содержится лимфатическая ткань, включая селезенку и печень. После чего назначают целый ряд исследований:
В онкологическом центре «Лапино-2» проводится полная диагностика лимфомы – быстро, без очередей и потерь драгоценного времени, на самом современном оборудовании.
Наши специалисты ведут пациента «от» и «до» – от обследования до проведения любого лечения.
Стадии лимфомы
Сразу после обнаружения заболевания врачи определяют его стадию – выясняют, как далеко оно успело распространиться и какие ткани повредило. Данная информация крайне важна для специалистов, поскольку она позволяет не только понимать прогнозы пациента, но и подбирать для него самое подходящее лечение.
Стадии неходжкинских лимфом:
I: измененные клетки обнаруживаются только в 1 группе лимфатических узлов или одном лимфоидном органе, например, миндалинах; либо в 1 области одного органа за пределами лимфатической системы.
II: они присутствуют в 2 или более группах лимфоузлов по 1 сторону от диафрагмы; либо в лимфатических узлах и 1 области расположенного рядом одного органа, или в еще одной группе лимфоузлов на той же стороне диафрагмы.
III: клетки лимфомы есть в лимфоузлах по обе стороны от диафрагмы; либо они присутствуют и в лимфатических узлах над диафрагмой, и в селезенке.
IV: заболевание распространилось по крайней мере в один орган, не входящий в лимфатическую систему, такой как печень, костный мозг или легкие.
Лечение лимфомы
Лечение лимфомы – задача непростая. Для ее решения требуется не один доктор, а целая команда профессионалов своего дела – химиотерапевта, радиолога, хирурга, онколога, гематолога и других.
В онкологическом центре «Лапино-2» есть все необходимые специалисты – врачи мирового уровня, которые проводят полную диагностику заболевания и любую необходимую терапию.
У нас вам не придется пересдавать анализы, переделывать исследования и задаваться вопросом «что делать дальше?». Мы полностью ведем пациента и даем ему четкий план действий, следуя которому он получает лучший результат из возможных.
Для борьбы с данным типом онкологии применяется несколько методов:
Основным из них является химиотерапия – препараты, которые уничтожают измененные клетки. Они принимаются в виде таблеток или вводятся в вену, попадают в кровоток и распространяются по всему телу. Лечение проводится циклами, каждый из которых длится несколько недель, после чего следует период отдыха, за время которого организм восстанавливается.
Трансплантация костного мозга или стволовых клеток, из которых образуются клетки крови. Процедура позволяет назначать более высокие дозы химиотерапии, иногда вместе с лучевой терапией, благодаря чему лимфома уничтожается эффективнее. Пересадка возможна не только донорского, но и своего собственного, собранного за несколько недель до вмешательства материала.
Лучевая терапия – уничтожение измененных клеток с помощью радиации. Данный метод подходит для большинства пациентов, и особенно хорошо работает, если заболевание успело поразить небольшое количество тканей. Его применяют как самостоятельно, так и в сочетании с химиотерапией.
Иммунотерапия – препараты, которые помогают собственной иммунной системе человека лучше распознавать и разрушать неправильные клетки. Существует несколько их типов, применяемых при лимфомах. К ним относят:
Хирургия: часто используется для получения образцов подозрительных тканей и определения их типа, но редко – для терапии как таковой. В редких случаях операции назначаются при поражениях селезенки или других органов, которые не входят в лимфатическую систему – например, щитовидная железа или желудок.
Прогнозы и продолжительность жизни при лимфоме
Перспективы каждого человека индивидуальны – они зависят от множества различных факторов, таких как тип заболевания, его стадия, ответ на лечение, возраст и общее состояние здоровья.
Наличие некоторых из них говорит о менее благоприятных прогнозах:
Для составления примерных прогнозов врачи используют специальный термин – «пятилетняя выживаемость». Это статистический показатель, который ничего не говорит о шансах конкретного человека. Он показывает только количество людей с определенным типом заболевания на конкретной стадии, остающихся в живых спустя 5 или более лет с момента постановки диагноза.
У пациентов с лимфомой Ходжкина эта цифра выглядит следующим образом:
Для пациентов с различными видами неходжкинских лимфом – диффузной В-крупноклеточной Диффузная В-крупноклеточная лимфома – это целая группа опухолей лимфатической системы, которая развивается из В-клеток вилочковой железы, или тимуса. и фолликулярной Фолликулярная лимфома – самая распространенная из медленно растущих типов заболевания, она составляет 20-30% от всех впервые диагностированных неходжкинских лимфом. она составляет 73% и 96%, 73% и 90%, 57% и 85% соответственно.
Первичная лимфома центральной нервной системы: клиника, диагностика, современные подходы к лечению (обзор литературы).
Бублиевский Д.В., Евзиков Г.Ю., Дегтярев Д.А.
Первичная лимфома центральной нервной системы: клиника, диагностика, современные подходы к лечению (обзор литературы).
Клиника нервных болезней ММА им. И.М. Сеченова.
Неходжкинская лимфома (НХЛ) – это гетерогенная группа злокачественных лимфопролиферативных заболеваний, различающихся по биологическим свойствам, морфологии, клиническим проявлениям и прогнозу лечения. НХЛ начинаются с появления одиночного опухолевого узла с возможным распространением путем лимфогенного и гематогенного метастазирования. В зависимости от локализации первичного патологического очага выделяют нодальное (первично поражены лимфатические узлы) и экстранодальное (в других органах) расположение. Первичная лимфома центральной нервной системы (ПЛ ЦНС) – одна из форм НХЛ, относящаяся к числу первичных экстранодальных лимфом. Она представляет собой злокачественную опухоль, развивающаяся в пределах ЦНС, без метастазирования в другие органы и не выступающая проявлением системной лимфопролиферативной патологии. Механизм лимфопролиферативного поражения ЦНС до настоящего времени неясен (62,72). Помимо поражения первичной лимфомой возможны варианты метастатического поражения ЦНС при генерализации нодальных лимфом и экстранодальных лимфом других органов.
Впервые морфологическое описание ПЛ ЦНС сделано Bailey [8] 1929г, но до 1970г опухоль встречается под названиями «периваскулярная саркома», «ретикулосаркома», «микроглиома».
Большинство ПЛ ЦНС (свыше 95%) поражают головной мозг, от 1 до 5% образований обнаруживаются в спинном мозге. При поражении головного мозга 85% опухолей располагаются супратенториально. В большинстве наблюдений (60%) образования располагаются в белом веществе мозга паравентрикулярно, в 5-18% — в мозолистом теле (52; 31; 18, 11).От 25 до 50% опухолей имеет множественную локализацию (31,90).
Множественное поражение более характерно для ВИЧ-позитивных больных в противоположность иммунокомпетентным пациентам, у которых 70% ПЛЦНС являются солитарными опухолями(11).Прорастание в оболочки мозга наблюдается в 30-40% случаев первичных лимфом ЦНС.
При нормальном иммунитете частота возникновения ПЛ ЦНС — 0,3 новых случая на 100000 населения в год, при СПИДе — 4,7:1 000 больных в год. Пик заболеваемости приходится на начало 90-х годов прошлого века (71), что нельзя объяснить только распространением синдрома приобретенного иммунодефицита (23,42,45 ), поскольку возросла также частота возникновения ПЛ у иммунокомпетентных больных. Тем не менее, наметившуюся тенденцию к спаду заболеваемости связывают с началом применения высокоспецифичная антиретровирусная терапия (ВААРТ) (21,102).
ПЛ ЦНС, подобно другим НХЛ у иммунокомпетентных больных обнаруживаются главным образом у пожилых пациентов (средний возраст заболевших — 60 лет). Частота встречаемости увеличивается с возрастом в четыре раза интенсивнее, чем НХЛ в целом [66]. Заболевание чаще встречается у мужчин (19).
У молодых пациентов ПЛ ЦНС (средний возраст варьирует от 31 до 36 лет), как и другие НХЛ, достоверно чаще развиваются при различных заболеваниях, сопровождающихся иммунодепрессией (36, 76,86).: 1) первичных иммунодефицитных синдромах и иммунных заболеваниях (атаксия-телеангиэктазия, синдром Вискотта–Олдрича, общий вариабельный иммунодефицит, тяжелый комбинированный иммунодефицит, синдром разрыва Nijmegen, гипер IgM-синдром, аутоиммунный лимфопролиферативный синдром); 2) ВИЧ-инфекции; 3) после трансплантации аллогенных солидных органов или костного мозга, и тогда ПЛ ЦНС является одной из разновидностей PTLD (посттрансплантационное лимфопролиферативное заболевание) (83) вследствие подавления Т-клеточного звена иммунного ответа и бурной пролиферации В
лимфоцитов.; 4) при иммуносупрессивной терапии аутоиммунных или воспалительных заболеваний, таких как ревматоидный артрит, системная красная волчанка, саркоидоз [30,103].
Одной из отличительных черт, характерных для ПЛ ЦНС у ВИЧ-позитивных пациентов а также у больных, перенесших трансплантацию органа, заключается в том, что опухоль почти всегда содержит вирус Эпштейна—Барра, в противоположность спорадической лимфоме ЦНС [16, 26, 84].
Генетика
В клетках ПЛ ЦНС находят нарушения структуры 1, 6, 7 и 14 хромосом, которые характерны для НХЛ [51]. В анализ маркёров клеточной поверхности включается NCAM
и интегрины, которые также характерны для неходжкинской лимфомы. Kumanishi и др. обнаружили р15 и р16 делеции у 4 из 5 больных ПЛ ЦНС [59].
Патоморфология.
В клинической практике для характеристики гистологических вариантов НХЛ используется классификация ВОЗ 2001 г. (схема №1). Морфологические варианты ПЛ ЦНС включают (по классификации REAL — 44): В-клеточную и Т-клеточную формы. Несмотря на отсутствие в норме В-лимфоцитов в мозговой ткани, В-клеточная лимфома и ее различные подтипы (диффузная крупноклеточная (ДККЛ), иммунобластная и лимфобластная) составляют подавляющее большинство ПЛ ЦНС (до 95%)[4,7,10]. Наиболее частой формой ПЛ ЦНС является ДККЛ. На долю лимфобластных В
клеточных, беркиттоподобных лимфом, лимфом Беркитта и Т-клеточных лимфом приходится только около 10%случаев.
Подавляющее большинство ПЛ ЦНС относят к опухолям высокой степени злокачественности. Описания Low-grade (низкой степени злокачественности ) лимфом носят единичный характер. В литературе насчитывают всего около 40 случаев (53). Микроскопическая картина В-клеточной лимфомы представляет собой диффузную инфильтрацию ткани мозга пролиферирующими В-клетками, среди которых встречаются нормальные Т-лимфоциты и астроциты, с ангиоцентрическим характером роста (65). Макроскопически такой очаг серого цвета, имеет мягко-эластическую консистенцию, без четко очерченных границ с окружающей мозговой тканью.
Первично лептоменингеальная форма без паренхиматозного поражения наблюдается у 7% пациентов (18, 60). При этом стоит отметить высокую частоту вовлечения мозговых оболочек в случаях вторичного (метастатического) поражения головного мозга лимфомой (90).
Клинические формы
Широкая вариабельность клинической картины поражения ЦНС находится в закономерной зависимости от локализации опухоли. Время от начала клинических проявлений до постановки диагноза составляет в среднем 3 месяца у больных с интактным иммунитетом и 2 месяца у пациентов с ВИЧ (35). Постановка диагноза может быть отсрочена по причине назначения кортикостероидов (104).
При манифестации новообразования головного мозга очаговая симптоматика наблюдается у 70% больных, нейропсихиатрические симптомы (апатия, депрессия, снижение мыслительных процессов) и изменения личности — у 43% при инфильтрации опухолью проводящих путей паравентрикулярной зоны или мозолистого тела; картина,
обусловленная внутричерепной гипертензией – у 33%, эписиндром – у 10-14%, клиника поражения зрительного тракта – в 4% случаев [11,35,66 ]
Несмотря на довольно частое вовлечение в процесс мозговых оболочек (около 40%), подтвержденное цитологическим исследованием ликвора, клинически оно проявляется реже (менее трети случаев) и характеризуется прогрессирующей слабостью в нижних конечностях, дизурией, повышением внутричерепного давления, а также нарушениями сознания [11, 9].
Поражение глаз (стекловидного тела, сетчатки, глазного нерва) манифестирует различными нарушениями зрения (характерны жалобы на «затуманивание» зрения, «расплывчатость предметов»), может протекать субклинически (до 20%)(17). Этот феномен встречается у 10-20% больных с ПЛ ЦНС и в ряде случаев может быть единственным проявлением заболевания (33,49,83).
Поражение спинного мозга ПЛ ЦНС встречается редко, представляет собой единичные или множественные интрамедуллярные очаги и имеет неблагоприятный прогноз (57,63). Манифестацией интрамедуллярной лимфомы могут явиться парестезии, нарушения чувствительности и парезы в конечностях, онемение в промежности и расстройства функции тазовых органов.
Другие клинические формы ПЛ ЦНС (лимфома атипичной локализации), такие как лимфома гипофиза, эпифиза, первичная дуральная лимфома, лимфоматозная инфильтрация краниальных нервов, ствола мозга, кавернозного синуса наблюдаются крайне редко и в большинстве встречаются у пациентов с СПИД.
Диагностика.
Клиническая картина ПЛ ЦНС не отличается от клиники патологических объемных образований головного и спинного мозга другой природы (первичные или метастатические опухоли или абсцессы). Поэтому провести дифференциальную диагностику на основании клинических проявлений невозможно. Современная диагностика должна основываться на сочетании клинических данных, картины нейровизуализации и данных онкологического поиска. При подозрении на ПЛ ЦНС наряду с неврологическим осмотром и нейровизуализацией необходимы тщательное пальпаторное обследование всех групп периферических лимфатических узлов печени и
селезенки а также КТ – исследование грудной клетки и УЗИ органов брюшной полости и почек, чтобы выяснить, не является ли очаг в ЦНС вторичным по отношению к системной лимфоме (что происходит в 5-29% случаев)( 36, 67).
С этой же целью выполняется биопсия костного мозга (трепанобиопсия крыла подвздошной кости) с последующей миелограммой. Для исключения поражения глаз всем больным рекомендовано проводить офтальмоскопию с исследованием глазного дна (1).
Ряд исследователей считает, что исследование ликвора (полученного путем люмбальной пункции при отсутствии повышения ВЧД) на предмет наличия опухолевых клеток необходимо проводить всем пациентам с подозрением на НХЛ ЦНС. В большинстве случаев при этом выявляется увеличение количества белка, иногда свыше 1,5 г/л. Плеоцитоз обнаруживается у 50% больных и представлен опухолевыми клетками или реактивными лимфоцитами.(9). При поражении оболочек мозга в спинномозговой жидкости может обнаруживаться увеличение уровня опухолевых маркеров (ß2-
микроглобулин, ЛДГ) (1). Исследование люмбального ликвора встречает возражения со стороны других авторов, которые мотивируют отсутствие необходимости проведения данного диагностического мероприятия слишком малым числом случаев цитологических находок либо неспецифичностью полученных данных. (50,84). Исследование СМЖ методом ПЦР на вирус Эпштейна—Барра также является спорным по своему диагностическому значению.
Основным методом диагностики ПЛ ЦНС является нейровизуализация. Трудность постановки правильного визуализационного диагноза при ПЛ ЦНС связана с отсутствием четких дифференциальных критериев между лимфомой и опухолями иной природы при нейровизуализации. При КТ опухоль выглядит обычно изо- или (чаще)
гиперденсивным внутримозговым очагом, относительно гомогенным после внутривенного контрастирования, который может достигать межполушарной щели или даже переходить на противоположное полушарие. При МР-томографии в типичных случаях в глубине перивентрикулярной паренхимы мозга, часто с вовлечением мозолистого тела и базальных ганглиев, определяются солитарный или множественные очаги с четкими (реже наоборот) контурами, гипоинтенсивные серому веществу мозга в Т1-режиме и гипер- или изоинтенсивные в Т2-режиме, гомогенные, с умеренно выраженным перифокальным вазогенным отеком и хорошим контрастным усилением (74%) после внутривенного введения парамагнетика (2,18,27,31,37,52). Накопление контрастного препарата, а также интенсивность и гетерогенность этого накопления прямо коррелируют с фактом применения кортикостероидной терапии (84). Прием гормонов
сопровождается снижением интенсивности и гомогенности контрастирования либо полным его отсутствием. У ВИЧ-инфицированных пациентов часто встречаемая мультифокальность поражения дополняется наличием кистозного и/или некротического компонента (64%) и, как следствие, гетерогенным типом контрастного усиления. (55,64). Для пациентов с иммуносупрессией также характерен периферический (кольцевидный) тип накопления парамагнетика (29,31). Присутствие очагов кровоизлияний редко отмечается у пациентов с СПИД (52). Кальцификация обнаруживается у больных, прошедших курс радио- и/или химиотерапии. Перивентрикулярные очаги часто врастают в желудочки мозга и инфильтрируют эпендиму (38%). Важным критерием с диагностической точки зрения представляется факт уменьшения размеров лимфомы в ответ на стероидную терапию, традиционно назначаемую для купирования перифокального отека. Причиной возможного уменьшения размеров опухоли (в ряде случаев – до невозможности обнаружения при нейровизуализации) является усиление апоптоза клеток лимфомы под действием глюкокортикоидов (56). Продолжительность периода нормализации нейровизуализационной картины может составлять несколько месяцев. Регресс изменений при нейровизуализации как правило совпадает с клиническим улучшением.
В дифференциальной диагностике на первом месте (особенно у ВИЧ-позитивных пациентов) стоит церебральный токсоплазмоз (27). В таких случаях возможно исследование на антитела к токсоплазме; можно назначить антипаразитарные препараты ex juvantibus и тогда косвенным подтверждением диагноза ПЛ ЦНС является неэффективность проводимой терапии (1, 29, 81).
Дифференциальный диагноз солитарной ПЛ ЦНС должен включать абсцесс, опухоли глиального ряда, метастазы солидных опухолей в головной мозг, герпетический энцефалит, демиелинизирующий процесс [25]. Определенное сходство с ПЛ ЦНС по нейровизуализационным характеристикам имеется также у интракраниальных менингиом
(оба типа опухолей могут иметь округлую форму и гомогенно накапливать контрастный препарат).
Лечение.
Первичное симптоматическое и синдромальное лечение, как при прочих интракраниальных объемных поражениях, особенно в случае неясного диагноза, должно включать использование дексаметазона, 32-48 мг/сут в 4-6 приемов. Глюкокортикоиды снижают отек мозга, а также специфически воздействуют на ткань опухоли, вызывая значительное уменьшение лимфомы ЦНС в размерах у 40% больных (99). Однако, в случаях нормализации нейровизуализационных изменений и улучшении клинических показателей под действием кортикостероидов, ремиссии имеют длительность 4 – 6 мес., после этого срока происходит рецидив, при этом больные уже не реагируют на стероиды(48).
В случае ятрогенной иммунодепрессии первичное лечение включает отмену или, по крайней мере, снижение дозы иммуносупрессантов (84).
Подавляющее большинство авторов указывают на неэффективность хирургии и четко определяют границы его применения: хирургическое вмешательство при ПЛ ЦНС показано исключительно с диагностической целью, так как удаление опухоли не увеличивает медиану выживаемости больных и может привести к усугублению неврологического дефицита (89). Биопсия же дает возможность точной гистологической диагностики опухоли с предоставлением важных морфологических характеристик для последующего подбора схемы химиотерапии или лучевой терапии.
В ряде случаев опухоль, затрудняющая отток СМЖ, может вызвать быстропрогрессирующую окклюзионную гидроцефалию. В этих ситуациях неотложное вентрикулярное дренирование может помочь спасти жизнь больного. Проведение
шунтирующей операции (вентрикулоатрио- или вентрикулоперитонеостомии) не показано вследствие гипотетической возможности обсеменения других органов и систем опухолевыми клетками, циркулирующими в СМЖ.. Шунтирующие операции на вентрикулярной системе мозга в ряде случаев применяются как паллиатив при развитии викарной гидроцефалии у пожилых, перенесших радиотерапию по поводу ПЛ ЦНС (5,95).
Долгое время метод тотального облучения головного и/или спинного мозга был единственным в лечении ПЛ ЦНС независимо от ВИЧ-статуса (15). Облучение головного мозга у взрослых, не имеющих ВИЧ – инфекции, в дозе 40–45 Гр (фракционно по 1,8 Гр) обеспечивает медиану выживаемости до 12–18 мес. Показатель 5-летней выживаемости —
менее 5%. Дальнейшее увеличение суммарной дозы облучения не ведет к улучшению результатов [73, 28]. У ВИЧ-инфицированных до появления ВААРТ лучевая терапия позволяла продлить жизнь не более чем на 1 — 3 месяца (36).
В настоящее время изолированная лучевая терапия имеет минимальное значение. Успехи полихимиотерапии позволили значительно ограничить ее использование. В современных лечебных протоколах она применяется только при не-В-клеточных лимфомах для облучения головного мозга и в лечении рецидивов. Отказ от лучевой терапии у больных с ПЛ ЦНС обусловлен высокой отсроченной нейротоксичность. Связанная с облучением
лейкоэнцефалопатия (особенно у пожилых пациентов старше 60 лет) достигает 90%. Клинически она проявляется в виде триады Хакима-Адамса. Для снижения риска лейкоэнцефалопатии предлагается использовать гиперфракционирование лучевой нагрузки (6,7, 25).
Химиотерапия и Комбинированная терапия.
Стандартные режимы химиотерапии НХЛ (СНОР, МАСОР-В) демонстрируют высокую эффективность в достижении полной ремиссии у больных, страдающих системной лимфомой (79, 92, 70). Однако, эти схемы не давали результатов при попытках их использования в лечении ПЛ ЦНС. Даже в сочетании с лучевой терапией они не приводили к увеличению выживаемости по сравнению с изолированной лучевой терапией (94).
Результаты лечения улучшились после внедрения в практику цитостатиков, проникающих через гематоэнцефалический (или гематоофталмический – при глазной форме лимфомы) барьер. В настоящее время основой химиотерапии ПЛ ЦНС является внутривенная инфузия высоких доз метотрексата, который в дозе 1 г/м2 проникает через гематоэнцефалический барьер, а в дозе 3,5 г/м2 обеспечивает поддержание терапевтической (цитотоксической по отношению к опухоли) концентрации в ликворе
более 24ч. Изолированное использование цитостатика дает медиану общей выживаемости в 25-55 месяцев, а медиану проживания без признаков прогрессивного опухолевого роста — 10-13 месяцев (7,41,26).
Дополнительное интратекальное введение метотрексата позволяет получить еще более высокую концентрацию препарата в ликворе и повышает медиану выживаемости до 60 мес (7). Помимо эндолюмбальной инфузии или введения цитостатика в желудочковую систему через интравентрикулярный катетер, некоторые исследователи практикуют подведение препарата непосредственно к ткани опухоли или к пограничной ткани мозга путем предварительной имплантации резервуара Оммайя ( 25, 34, 58).
Практикуется также внутриартериальное введение метотрексата, циклофосфамида и карбоплатина с применением гиперосмолярных агентов (так называемый «осмотический прорыв гематоэнцефалического барьера») посредством катетеризации внутренней сонной или позвоночной артерий (по Сельдингеру). Несмотря на возможность существенно повысить концентрацию препарата и высокую эффективность, в связи с побочными действиями (травмы артерий, повышение внутричерепного давления, провокация эпилептических припадков) этот способ используется редко (53, 68,91).
Наряду с метотрексатом используются и другие цитостатики. Наибольшее распространение получил прокарбазин, также хорошо проникающий через ГАБ (8). Цитарабин также находит применение, в том числе, и в проведении дополнительного пострадиационного курса химиотерапии (38).
Многие авторы считают, что комбинация высокодозного метотрексата с другими цитостатиками по клиническому эффекту имеет преимущество в сравнении с изолированной терапией метотрексатом. Протокол, включающий применение внутривенной инфузии метотрексата (3,5 г/м2), прокарбазина (100 мг/м2/сут) и винкристина (1,4 мг/м2), позволяет достигать общей медианы выживаемости в 50-60 мес.
До настоящего времени целесообразность сочетания химиотерапии и лучевой терапии остается предметом дискуссии. Комбинация метотрексата в пониженных дозах (1–3,5 г/м2) с тотальным облучением мозга сопровождается медианой выживаемости 20-41 месяц (12,13,46,47,39,41,43). Комбинация высокодозного метатрексата с тотальным облучение м головного мозга ведет к значительному увеличению медианы общей выживаемости больных. Показатель 2-летней выживаемости составляет – 50-70%, 5-
ПЛ ЦНС у лиц пожилого возраста сопровождается высоким риском развития вышеуказанных неврологических симптомов.
Необходимость, с одной стороны, достижения эффективных терапевтических доз химиопрепаратов в точке мишени, а с другой — предотвращения нейротоксичности и возникновения когнитивных нарушений побуждают к поиску менее агрессивных (но не менее эффективных в отношении основного заболевания) протоколов химиотерапии. Имеются сообщения об использовании темозоламида, относительно новым режимом также является протокол PEPSO (комбинация прокарбазина, цисплатина, винкристина и вепезида) (25,85).
Другие методы лечения.
С целью возможного использования при лечении ПЛ ЦНС проходит испытания в лабораторных условиях препарат Целебрекс (ингибитор циклооксигеназы-2). Его эффективность и направленная цитотоксичность, как предполагают исследователи, обусловлена индукцией апоптоза клеток лимфомы. Кроме того, на фоне приема целебрекса отмечается повышение радио- и химиосенситивности патологической лимфоидной ткани (97).
При лечении терапевтически резистентных форм и в случае возникновения рецидивов, чувствительных к химиотерапии, используется трансплантация костного мозга или
периферических стволовых клеток, часто в сочетании с высокодозной полихимиотерапией (цитарабин, этопозид). Различают трансплантацию аутологичных (от самого больного) и аллогенных (от донора) клеток костного мозга или периферической крови. Поражение костного мозга или периферической крови лимфомными клетками исключает возможность использования аутологичной трансплантации.
Костный мозг или периферические стволовые клетки при аутотрансплантации получают от больного до начала интенсивной химиотерапии или облучения, а затем вновь возвращают больному после проведенного лечения для восстановления показателей крови. Через 2-3 недели начинают повышаться показатели лейкоцитов, а затем —
тромбоцитов и эритроцитов. Трансплантация аутологичных стволовых кроветворных клеток в настоящее время находится на стадии внедрения в клиническую практику. Имеются только единичные сообщения о высокой эффективности метода. Так, в группе молодых больных с рефрактерной к химиотерапии и рецидивирующей НХЛ ЦНС, которым была проведена трансплантация, у 73% получена полная ремиссия, 3-летняя выживаемость составила 64%. При этом, только у 32% больных отмечены проявления нейротоксичности. В другом исследовании, в группе больных с неблагоприятным исходным показателем шкалы Karnofsky получен 100%-ный «ответ» опухоли на терапию [93,20]. Предварительные результаты мультицентрового исследования (77) подтверждают эффективность вышеописанной методики лечения.
Для ВИЧ-инфицированных пациентов решающий фактор во всех случаях независимо от выбранной терапии — максимально возможное восстановление иммунитета. Благодаря применению высокоактивной антиретровирусной терапии (ВААРТ) можно продлить жизнь больного на несколько лет. Полные ремиссии описаны даже на фоне одной только ВААРТ (69,22,87,88).
α-интерферон с успехом применяется(32,101) как заместительная терапия при PTLD (что объясняется хромосомным дефектом, связанным с делецией участка, ответственного за выработку нативного α-интерферона).
Прогноз.
В отсутствие лечебных мероприятий время жизни пациентов в среднем составляет 3 месяца. Средняя продолжительность жизни после курса глюкокортикоидов и облучения у больных с нормальным иммунитетом — 12-24 мес. Прогрессирование лимфомы с распространением на другие отделы ЦНС отмечается у 50–80% [100]. Спустя 1 год у 60% больных обнаруживают обширную опухолевую диссеминацию по ЦНС, а у 7-10% —
генерализованную лимфому. [25,74].
Для прогнозирования скорости роста опухоли (равно как и любых форм НХЛ) и эффективности лечения разработан международный прогностический индекс (МПИ), который учитывает 5 клинических характеристик : возраст больного, стадию заболевания по классификации Ann Arbor (1971), поражение не только лимфатических узлов, но и других органов (экстранодальное распространение), общее состояние больного по шкале Karnofsky, уровень лактатдегидрогеназы (ЛДГ) в сыворотке крови. Каждый показатель МПИ оценивается в 1 балл. Наличие двух и более баллов отрицательно сказываются на прогнозе заболевания, независимо от морфологического варианта опухоли.
К благоприятным прогностическим факторам относятся: возраст менее 60 лет, стадии I-II (локализованный процесс), хорошее общее состояние, нормальные уровни ЛДГ. К неблагоприятным прогностическим факторам относятся: возраст пациента выше 60 лет, стадии III и IV(распространенный процесс), неудовлетворительное общее состояние низкий статус по шкале Karnofsky – менее 50). и повышение уровней ЛДГ. Несмотря на улучшение результатов лечения, отмеченное в последние годы на фоне более широкого внедрения цитостатиков в виде монотерапии и различных сочетаний цитостатических препаратов, прогноз при НЛ ЦНС остается неблагоприятным. Медиана выживаемости при анализе больших групп пациентов составляет 37 мес, среднее время отсутствия прогрессивного опухолевого роста — 2 года, 5-летняя выживаемость – 5–10% [74].
1. Богданов А.Н., Максимов А.Г., Саржевский В.О., Аносов Н.А. Особые формы неходжкинских лимфом. Практическая онкология Т. 5, № 3 – 2004 — c. 216-222. Военномедицинская академия, СанктПетербург
3. Abrey L.E., DeAngelis L.M., Yahalom J. Long-term survival in primary CNS lymphoma // J Clin Oncol. – 1998. – Vol. 16. – P. 859-863.
4. Abrey L., Paulus W., Jellinger K., Morgello S., Deckert-Schluter M. Malignant lymphomas // World Health Organization Classification of Tumour Pathology and Genetics of Tumours of the Nervous System. — Lyon: IARC Press, 2000. — P. 198–203.
6. Abrey L.E., Yahalom J., DeAngelis L.M. Relapse and late neurotoxicity in primary central nervous system lymphoma [abstract] // Neurology. – 1997. – Vol. 48. — A18.
7. Abrey L.E., Yahalom J, DeAngelis L.M. Treatment for primary CNS lymphoma: The next step // J Clin Oncol. – 2000. – Vol. 18. – P. 3144- 3150.
8. Bailey P. Intracranial sarcomatous tumors of leptomeningeal origin // Arch Surg. – 1929. Vol. 18. – P. 1359-1402.
9. Balmaceda C., Gaynor J.J., Sun M., Gluck J.T., DeAngelis L.M. Leptomeningeal tumor in primary central nervous system lymphoma: recognition, significance, and implications // Ann Neurol. – 1995. — Vol. 38. – P. 202–209.
10. Bashir R., Chamberlain M., Ruby E., Hochberg F.H. Tcell infiltration of primary CNS lymphoma // Neurology. – 1996. – Vol.46. – Р. 440.
11. Bataille B., Delwail V., Menet E., Vandermarcq P., Ingrand P., Wager M., et al. Primary intracerebral malignant lymphoma: report of 248 cases // J Neurosurg. — 2000. – Vol. 92. – P. 261–266.
12. Batchelor T., Carson K., O’Neill A., Grossman S.A., Alavi J., New P. et al. Treatment of primary CNS lymphoma with methotrexate and deferred radiotherapy: a report of NABTT 96–07 // J Clin Oncol. – 2003. — Vol. 21. — P: 1044–1049.
13. Batchelor T., Grossman S.A., Carson K., Fisher J. Updated results from NABTT CNS Consortium studies in primary CNS lymphoma // Ann Oncol. – 2005. – Vol. 125, № 16 (Abstract #297)
14. Borit A., Altrocchi P.H. Recurrent polyneuropathy and neurolymphomatosis // Arch Neurol. – 1971. – Vol. 24. – P. 40–49.
15. Brada M., Dearnaley D., Horwich A., and Bloom H.J. Management of primary cerebral lymphoma with initial chemotherapy: Preliminary results and comparison with patients treated with radiotherapy alone. Int. J. Radiat. Oncol. Biol. Phys1990. 18, 787–792.
16. Brink N.S., Sharvell Y., Howard M.R., Fox J.D., Harrison M.J., and Miller R.F. Detection of Epstein-Barr virus and Kaposi’s sarcoma associated herpesvirus: DNA in CSF from persons infected with HIV who had neurological disease // J Neurol Neurosurg Psychiatry. – 1998. – Vol. 65. – P. 191-195.
17. Buggage R.R., Chan C.C., Nussenblatt R.B. Ocular manifestations of central nervous system lymphoma // Curr Opin Oncol. — 2001. – Vol. 13. – P. 137–142.
18. Buhring U., Herrlinger U. MRI features of primary central system lymphoma in presentation // Neurology. — 2001. – Vol. 57, № 3. – P. 393- 396.
19. CBTRUS: Primary Brain Tumors in the United States, 1998–2002. Statistical Report. — Chicago: Central Brain Tumor Registry of the United States, 2005.
20. 9 Cheng T. et al. High-dose thiotepa, busulfan, cyclophosphamide and ASCT without whole-brain radiotherapy for poor prognosis primary CNS lymphoma // Bone Marrow Transplant. – 2003. – Vol. 31. – P. 679–685.
21. Chow K.U., Mitrou P.S., Geduldig K., Helm E.B., Hoelzer D., Brodt H.R. Changing incidence and survival in patients with AIDSrelated non Hodgkin’s lymphomas in the era of highly active antiretroviral therapy (HAART) // Leuk Lymphoma — 2001. Vol. 41. – P. 105–116.
22. Corales R., Taege A., Rehm S., Schmitt S. Regression of AIDS-related CNS Lymphoma with HAART // XIII International AIDS-Conference. — Durban, South Africa, 2000.
23. Cote T.R., Manns A., Hardy C.R., Yellin F.J., Hartge P. Epidemiology of brain lymphoma among people with or without acquired immunodeficiency syndrome // J Natl Cancer Inst. – 1996. – Vol. 88. – P.675-679.
24. DeAngelis L.M. Primary central nervous system lymphomas // Curr Treat Options Oncol. — 2001. – Vol. 2. – P. 309–318.
25. DeAngelis L.M., Seiferheld W., Schold S.C., Fisher B., Schultz C.J. Combination chemotherapy and radiotherapy for primary central nervous system lymphoma: Radiation Therapy Oncology Group Study 93–100 // J Clin Oncol. – 2002. – Vol. 20. – P. 4643–4648.
26. DeAngelis L.M., Wong E., Rosenblum M., Furneaux H. EpsteinBarr virus in AIDS and nonAIDS primary central nervous system lymphoma // Cancer. – 1992. – Vol.70. – Р. 1607.
27. DeAngelis L.M., Yahalom J. Primary central nervous system lymphoma. Cancer: principles and practice of oncology. Philadelphia: Lippincott-Raven, 1997: 2233-2242
28. DeAngelis L.M., Yahalom J., Heinemann M.H., Cirrincione C., Thaler H.T., Krol G. Primary CNS lymphoma: combined treat-ment with chemotherapy and radiotherapy // Neurology. – 1990. – Vol. 40. – P. 80–86.
29. Dina T.S. Primary central nervous system lymphoma versus toxoplasmosis in AIDS // Radiology. – 1991. – Vol. 179. – P. 823-828.
30. Eichler A. F., Batchelor T.T. Primary central nervous system lymphoma: presentation, diagnosis, and staging // Neurosurg Focus. – 2006. — Vol. 21, № 5. — E16.
31. Eloraby A., Zaki I. Primary central system lymphoma: incorporating MRI in the planning of treatment strategies // J Egypt Nat Canc Inst. — 2001. — Vol. 13, № 3. – P. 237-244.
32. Faro A., Kurland G. et al. Interferon-alpha affects the immune response in post-transplant lymphoproliferative disorder. Am J Respir Crit Care Med. – 1996. – Vol.153. – P. 1442-1447.
33. Ferreri A.J., Blay J.Y., Reni M., Pasini F., Gubkin A., Tirelli U. et al. Relevance of intraocular involvement in the management of primary central nervous system lymphomas // Ann Oncol. – 2002. — Vol. 13. – P. 531–538.
35. Fine H.A., Loeffler J.S. Primary central nervous system lymphoma // The Lymphomas. — Philadelphia: W.B. Saunders, 1998. – P. 481–494. 36. Fine H.A., Mayer R.J. Primary central nervous lymphoma // Ann Intern Med. – 1993. – Vol. 119. – P. 1093-1104.
37. Floris R., Crecco M. Magnetic resonance features cerebral primary lymphoma in non immuneocompromised subject // Radio. Med (Torino). — 1997. – Vol. 98, № 3. – P. 236-241.
38. Frick J.C., Hansen R.M., Anderson T. et al. Successful high-dose intravenous cytarabine treatment of parenchymal brain involvement from malignant lymphoma // Arch Intern Med. — 1986. – Vol. 146. – P. 791-792.
39. Gabbai A.A., Hochberg F.H., Linggood R.M., Bashir R., Hotleman K. High-dose methotrexate for non-AIDS primary central nervous system lymphoma. Report of 13 cases // J Neurosurg. — 1989. – Vol. 70. — P. 190–194.
40.18 Gavrilovic I. et al. Long-term follow-up of patients with primary central nervous system lymphoma treated with a high-dose methotrexate regimen with or without whole brain radiotherapy // Neuro-oncol. – 2005. – Vol. 7. – P.349.
41. Glass J., Gruber M.L., Cher L. et al. Preirradiation methotrexate chemotherapy of primary central nervous system lymphoma: Long-term outcome // J Neurosurg. – 1994. – Vol. 81. – P. 188-195.
42. Goplen A.K., Dunlop O., Liestol K., Lingjaerde O.C., Bruun J.N., Maehlen J. The impact of primary central nervous system lymphoma in AIDS patients: a population-based autopsy study from Oslo // J Acquired Immune Defic Syndr Hum Retrovirol. – 1997. – Vol. 14. – P. 351-354.
43. Guha-Thakurta N., Damek D., Pollack C., Hochberg F.H. Intravenous methotrexate as initial treatment for primary central nervous system lymphoma: response to therapy and quality of life of patients // JNeurooncol. — 1999. – Vol. 43. – P. 259–268.
44. Harris N.L., Jaffe E.S., Stein H., Banks P.M., Chan J.K., Cleary M.L. et al. A revised European-American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group // Blood. – 1994. – Vol. 84. – P. 1361-1392.
45. Hartge P., Devessa S.S., Faunmeni J.F.Jr. Hodgkin’s and non-Hodgkin’s lymphoma // Cancer Surv. – 1994. – Vol. 20. – P. 423.
46. Herrlinger U., Kuker W., Uhl M., Blaicher H.P., Karnath H.O., Kanz L. et al. NOA-03 trial of high-dose methotrexate in primary central nervous system lymphoma: final report // Ann Neurol. – 2005. – Vol. 57, № 38. – P. 843–847.
47. Herrlinger U., Schabet M., Brugger W., Kortmann R.D., Kuker W., Deckert M. et al. German Cancer Society Neuro-Oncology Working Group NOA-03 multicenter trial of single-agent high dose methotrexate for primary central nervous system lymphoma // Ann Neurol. – 2002. – Vol. 51. – P.247–252.
48. Hochberg F.H., Pruitt A. Assumptions in the radiotherapy of glioblastoma // Neurology. — 1980. – Vol. 30 – P. 907–911.
49. Hormigo A., Abrey L., Heinemann M.H., DeAngelis L.M. Ocular presentation of primary central nervous system lymphoma: diagnosis and treatment // Br J Haematol. — 2004. – Vol. 126. – P. 202–208.
50. Hunt M. A., Jahnke K., Murillo T. P. et al. Distinguishing primary central nervous system lymphoma from other central nervous system diseases: a neurosurgical perspective on diagnostic dilemmas and approaches // Neurosurg Focus. – 2006. — Vol. 21, № 5. — E3.
51. Itoyama T., Sadamori N., Tsutsumi K. et al. Primary central nervous system lymphomas // Cancer. – 1994. Vol. 73. – P. 455-463.
52. Jack C.R. Jr, O’Neill B.P., Banks P.M., Reese D.F. et al. Primary central nervous system lymphoma: histologic types and CT appearance // Radiology. – 1988. – Vol. 167, № 23. – P. 211–215.
53. Jahnke K.et al. Implications of the blood–brain barrier in primary central nervous system lymphoma // Neurosurg Focus. – 2006. – Vol. 21, № 5. — E11.
54. Jahnke K., Korfel A., O’Neill B.P., Blay J.Y., Abrey L.E., Martus P. et al. International study on low-grade primary central nervous system lymphoma // Ann Neurol. – 2006. – Vol. 59. – P. 755–762.
55. Johnson B.A., Farmer E.K. Johnson P.C., Jacobowitz R. The variable MR appearance of primary lymphoma of central nervous system: comparison with hystopathologic features // Am J Neuroradiol. – 1997. – Vol. 18, № 3. – P. 653-72.
56. Kadoch C., Treseler P., Rubenstein J.L. Molecular pathogenesis of primary central nervous system lymphoma // Neurosurg Focus. – 2006. Vol 21, № 5. — E1.
57. Kawasaki K., Wakabayashi K., Koizumi T., Tanaka R., Takahashi H. Spinal cord involvement of primary central nervous system lymphomas: histopathological examination of 14 autopsy cases // Neuropathology. — 2002. – Vol. 22. – P.13–18. 58. Khan R.B., Weije S., Thaler H.T. et al. Is intrathecal methotrexate necessary in the treatment of primary CNS lymphoma? // J Neurooncol. – 2002. – Vol. 58. – P.175-178.
59. Kumanishi T., Zhang S., Ichikawa T., Endo S., Washiyama K. Primary malignant lymphoma of the brain: demonstration of frequent p16 and p15 gene deletions // Jpn J Cancer Res. — 1996. – Vol. 87. – P. 691-695.
60. Lachance D.H., O’Neill B.P., Macdonald D.R., Jaeckle K.A., Witzig T.E., Li C.Y. et al. Primary leptomeningeal lymphoma: report of 9 cases, diagnosis with immunocytochemical analysis, and review of the literature // Neurology. – 1991. – Vol. 41. – P. 95–100.
61. Lantos P.L., VandenBerg S.R., Kleihues P. Tumours of the nervous system. Greenfield’s Neuropathology, vol 2, ed 6. New York, Oxford University Press, 1997
62. Larocca L.M., Capello D. et al. The molecular and phenotypic profile of primary central nervous system lymphoma identifies distinct categories of the disease and is consistent with histogenetic derivation from germinal center-related B cells // Blood. – 1998. – Vol. 92. – P.1011- 1019.
63. Lee D.K., Chung C.K., Kim H.J., Kim K., Choe G., Moon C.W. et al. Multifocal primary CNS T-cell lymphoma of the spinal cord // Clin Neuropathol. – 2002. – Vol. 21. – P.149–155.
64. Lehrke R., Ernest R.I. CT and MR imaging in primary cerebral non-Hojkin’s lymphoma // Acta Radiol. – 1999. – Vol. 38, № 2, — P.259-267. 65. Lennert K., Feller A.G. Histopathologie der non-Hodgkin- Lymphome. 2nd edition, Springer-Verlag, Berlin, 1990. 66. Lutz J.M., Coleman M.P. Trends in primary cerebral lymphoma // Brit J Cancer. – 1994. –Vol. 716. – Р. 70.
68. McAllister L.D., Doolittle N.D., Guastadisegni P.E. et al. Cognitive outcomes and long-term follow-up after enhanced chemotherapy delivery for primary central nervous system lymphomas // Neurosurgery. – 2000. – Vol. 46. – P.51–61.
69. McGowan J.P., Shah S. Long-term remission of AIDS-related PCNSL associated with HAART // AIDS. – 1998. – P. 952-954.
70. Mead G.M., Bleehen N.M., Gregor A. et al. A Medical Research Council randomized trial in patients with primary cerebral non-Hodgkin lymphoma: Cerebral radiotherapy with and without cyclophosphamide, doxorubicin, vincristine, and prednisone chemotherapy // Cancer. – 2000. – Vol. 89. – P.1359-1370.
71. Miller D.C., Hochberg F.H., Harris N.L., Gruber M.L., Louis D.N., Cohen H. Pathology with clinical correlations of primary central nervous system non-Hodgkin’s lymphoma. The Massachusetts General Hospital experience 1958–1989 // Cancer. – 1994. – Vol. 74. – P.1383-1397
72. Morgello S. Pathogenesis and classification of primary central nervous system lymphoma: an update // Brain Pathol. – 1995. – Vol. 5. – P. 383-393.
73. Nelson D.F., Martz K.L., Bonner H. et al. NonHodgkin’s lymphoma of the brain: can high dose, large volume radiation therapy improve survival? Report on a prospective trial by the Radiation Therapy Oncology Group (RTOG): RTOG 8315 // Int. J. Radiat. Oncol. Biol. Phys. – 1992. – Vol.9. – Р. 23.
74. O’Brien P., Roos D., Pratt G., Liew K., Barton M., Poulsen M. et al. Phase II multicenter study of brief single-agent methotrexate followed by irradiation in primary CNS lymphoma // J Clin Oncol. – 2000. – Vol. 18. – P. 519–526.
75. Olson J.E., Janney C.A., Rao R.D., Cerhan J.R., Kurtin P.J., Schiff D. et al. The continuing increase in the incidence of primary central nervous system non-Hodgkin lymphoma: a surveillance, epidemiology, and end results analysis // Cancer. – 2002. – Vol. 95. – P.1504–1510. 76. Omuro A. M. P., Abrey L. E. Chemotherapy for primary central nervous system lymphoma // Neurosurg Focus. – 2006. – Vol. 21, № 5. — E12.
77. O’Neill B.P., O’Fallon J.R., Earle J.D. et al. Primary central nervous system non-Hodgkin’s lymphoma: Survival advantages with combined initial therapy? // Int J Radiat Oncol Biol Phys. — 1995. – Vol. 33. – P. 663-673.
78. O’Neill B.P., Illig J. Primary central nervous system lymphoma // Mayo Clin. Proc. – 1989. – Vol. 64. – P.1005-1020.
79. O’Neill, B.P., Kelly, P.J., Earle, J.D., Scheithauer, B., and Banks, (1987)
Computer-assisted stereotaxic biopsy for the diagnosis of primary central lymphoma. Neurology37, 1160-1164.
80. Omuro A.M.P., DeAngelis L.M., Yahalom J., Abrey L.E. Chemo- radiotherapy for primary CNS lymphoma: an intent-to-treat analysis with complete follow-up // Neurology. – 2005. – Vol. 64. – P.69–74.
81. Pels H. et al. Primary central nervous system lymphoma: results of a pilot and phase II study of systemic and intraventricular chemotherapy with deferred radiotherapy // J Clin Oncol. – 2003. – Vol. 21. – P. 4489–4495.
82. Peterson K., Gordon K.B., Heinemann M.H., DeAngelis L.M. The clinical spectrum of ocular lymphoma // Cancer. – 1993. – Vol. 72. – P. 843–849.
83. Phan T.G., O’Neill B. P., Kurtin P. J. Posttransplant primary CNS lymphoma // Neuro-Oncology. – 2000. – Vol. 10. – P. 229-238.
84. Poortmans P.M., Kluin-Nelemans H.C., Haaxma-Reiche H., Van’t Veer M., Hansen M., Soubeyran P. et al. High-dose methotrexate-based chemotherapy followed by consolidating radiotherapy in non-AIDS-related primary central nervous system lymphoma. European Organization for Research and Treatment of Cancer Lymphoma Group Phase II Trial 20962 // J Clin Oncol. – 2003. – Vol.21. – P. 4483–4488.
85. Porcu P., Caligiuri M.A. Acquired immunodeficiency syndrome-related lymphomas: future directions // Seminars in Oncology. – 2000. – Vol. 27, № 4. – P. 454-462.
86. Raez L., Cabral L., Cai J.P. et al. Treatment of AIDS-related primary central nervous system lymphoma with zidovudine, ganciclovir, and interleukin 2 // AIDS Res Hum Retroviruses. – 1999. – Vol. 15. – P. 713-719.
87. Rigolet A., Bossi P., Caumes E. et al. Epidemiological features and incidence trends of primary cerebral lymphomas observed in 80 HIV infected patients from 1983 to 1999 // Pathol Biol (Paris). – 2001. – Vol. 49. – P. 572-575.
88. Roman-Goldstein S., Goldman D., Howieson.J, et al. MRI of primary CNS lymphoma in immunologically normal patients // Am J Neuroradiol. – 1992. – Vol.13. – P.1207–1213.
89. Russell and Rubinstein’s Pathology of Tumors of the Nervous System, 6th edn. Arnold, a member of Hodder Headline Group: London; 1998. p. 198-210
90. Sandlund J.T., Murphy S.B., Santana V.M. et al. CNS involvement in children with newly diagnosed non-Hodgkin’s lymphoma // J Clin Oncol. – 2000. – Vol. 18. – P. 3018-3024.
91. Schultz C., Scott C., Sherman W. et al. Preirradiation chemotherapy with cyclophosphamide, doxorubicin, vincristine, and dexamethasone for primary CNS lymphomas: Initial report of Radiation Therapy Oncology Group protocol 88-06 // J Clin Oncol. – 1996. – Vol. 14. – P. 556-564.
92. Soussain C. et al. Results of Intensive Chemotherapy Followed by Hematopoietic StemCell Rescue in 22 Patients With Refractory or Recurrent Primary CNS Lymphoma or Intraocular Lymphoma // J. Clin. Oncol. – 2001. – Vol.19. – Р. 742749.
93. Stewart D.J., Russell N., Atack E.A. Cyclophosphamide, adriamycin, vincristine, and dexamethasone in the treatment of Enhanced delivery improves the efficacy of a tumor-specific bulky central nervous system lymphoma, in Walker MD,Thomas DGT (eds): Biology of Brain Tumours: Proceedings of the Second International Symposium on Biology of Brain Tumour (London, October 24–26, 1984). Boston: Martinus Nijoff, 1986, pp 431–434
94. Thiessen B., DeAngelis L.M. Hydrocephalus in radiation leukoencephalopathy: results of ventriculoperitoneal shunting // Arch Neurol. – 1998. – Vol. 55. – P. 705-710.
95. Valluri S., Moorthy R.S., Khan A., Rao N.A. Combination treatment of intraocular lymphoma // Retina. – 1995. – Vol.15. – Р. 125.
96. Wang W. et al. Efficacy of celecoxib in the treatment of CNS lymphomas: an in vivo model // Neurosurg Focus. – 2006. – Vol. 21, № 5. — E14.
97. Welch K, Finkbeiner W, Alpers CE, et al. Autopsy findings in the acquired immune deficiency syndrome // JAMA. – 1984. – Vol. 252. – P.1152-1159.
98. Weller M. Glucocorticoid treatment of primary CNS lymphoma // J Neurol Oncol. – 1999. – Vol. 43. – P. 237-239.
99. Whitcup S.M., de Smet M.D., Rubin B.I. et al. Intraocular lymphoma clinical and histopathologic diagnosis // Ophthalmology. – 1993. – Vol.100. – Р. 1399.
100. Wood A., Angus B., Kestevan P., Dark J., Notarianni G., Miller S., Howard M. et al. Alpha interferon gene deletions in post-transplant lymphoma // Br. J. Haematol. – 1997. – Vol. 98. – P. 1002-1003.
101. Wolf T., Brodt H.R., Fichtlscherer S., Mantzsch K., Hoelzer D., Helm E.B. et al. Changing incidence and prognostic factors of survival in AIDS-related non-Hodgkin’s lymphoma in the era of highly active antiretroviral therapy (HAART) // Leuk Lymphoma. – 2005. – Vol. 46. – P. 207–215.
102. World Health Organization Classification of Tumours: Pathology and Genetics of Tumors of Haematopoietic and Lymphoma Tissues / Ed. by Jaffe E.S., Harris N.L., Stein H., Vardiman J.W. – Lyon: IARC Press, 2001. – 351р.
103. Zimmer C., Marzheuser S., Patt S., Rolfs A., Gottschalk J., Weigel K. et al. Stereotactic brain biopsy in AIDS // J Neurol. – 1992. – Vol. 239. – P. 394–400.