код по мкб 10 k59 9
Запор (K59.0)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Термин «запор» или «констипация» происходит от латинского constipatio (синоним – obstipatio), в дословном переводе – скопление.
Запором принято считать хроническую задержку опорожнения кишечника более чем на 48 часов, которая сопровождается чувством неполного опорожнения с отхождением малого количества кала повышенной твердости.
Следует различать запор как симптом какого-либо заболевания и функциональный запор.
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Существует много подходов к классификации запоров.
С практической и клинической точки зрения важно учитывать следующее разделение:
2. По типу моторных нарушений толстой кишки функциональные запоры разделяют на следующие типы:
— гиперсегментарный, гиперкинетический;
— гипо- и атонический.
— могут присутствовать боли в животе и вздутие живота.
3. Декомпенсированная стадия:
Этиология и патогенез
Основные причины развития функционального запора:
1. Алиментарные: недостаток балластных веществ и жидкости в рационе, малый объем пищи.
2. Лекарственные: прием холинолитиков, антидепрессантов, опиатов, мочегонных препаратов, нейролептиков и пр.).
3. Эндокринные: гипотиреоз, гиперпаратиреоз, сахарный диабет, менопауза.
4. Психогенные: в качестве симптома психических заболеваний, реакции на неблагоприятные условия для опорожнения кишечника.
5. Неврогенные: паркинсонизм, рассеянный склероз, спинальные расстройства.
6. Токсические: воздействие токсических веществ (свинец, ртуть и пр.).
7. Заболевания внутренних органов: хронические заболевания легких, печени, нарушение кровоснабжения).
8. Старческие: абдоминальная ишемия, гипоксия, снижение репарации тканей, гиподинамия.
Нарушение синтеза регуляторных интестинальных пептидов считается главным механизмом функционального запора. Это связано с тем, что регуляторные интестинальные пептиды отвечают за следующие процессы:
— моторику желудочно-кишечного тракта (ЖКТ);
— деградацию энтеральных нервных сплетений;
— снижение кровотока в малом тазу;
— прогрессирующую слабость мышц тазового дна;
— снижение чувствительности анального сфинктера;
— нарушение серотонинергической регуляции.
Основные причины функциональных запоров у детей
1. Алиментарные:
— количественный недокорм (отсутствует рефлекторный позыв на дефекацию);
— недостаток пищевых волокон в рационе;
— избыточное употребление жиров или белков (мяса, яиц);
— употребление большого количества протертых блюд;
— недостаточное употребление жидкости либо ее избыточные потери;
— нарушения режима питания, торопливая еда.
2. Психофизиологические:
— подавление позыва на дефекацию;
— «боязнь» горшка;
— невроз (социальная дезадаптация, личностные особенности).
3. Рефлекторные (при заболеваниях других органов).
В основе патогенеза функциональных запоров лежат расстройства моторной функции толстой кишки, которые появляются в результате дискоординации ее тонических и пропульсивных сокращений, нарушения тонуса мускулатуры кишки, а также изменения возбудимости вегетативной нервной системы.
Эпидемиология
Признак распространенности: Очень распространено
Соотношение полов(м/ж): 0.34
Пол. Преобладание женщин 3 :1.
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
К сожалению, не только больные, но и многие врачи расценивают хронические запоры как относительно доброкачественную патологию. Следует объективно оценивать общее состояние больных с запорами, которое может быть потенциально тяжелым, и разъяснять больным, что запоры отнюдь не безопасный симптом.
Клинические проявления функциональных запоров:
— изменение частоты стула;
— появление плотного кала;
— изменение акта дефекации.
Частые жалобы при функциональных запорах:
— дискомфорт в животе без четкой локализации, в основном в дневное время;
— метеоризм;
— снижение аппетита;
— снижение работоспособности, часто сопровождающееся депрессией и бессонницей.
Диагностика
Алгоритм диагностики при первом появлении запора
3-й этап включает применение специальных методов исследования для оценки моторно-эвакуаторной функции толстой кишки, состояния запирательного аппарата прямой кишки. Среди них: электромиография, изотопные методы, дефекография, анальная манометрия, исследования микробного спектра, коротко-цепочечных жирных кислот в кале).
Следование такой программе обследования позволяет определить, вызван ли запор каким-либо заболеванием или является функциональным расстройством. Диагноз функционального запора ставится методом исключения.
Длительное лечение у терапевта или гастроэнтеролога проводится только после осуществления диагностики, определения форм, подлежащих хирургическому лечению, привлечения к лечению эндокринологов, гинекологов, психотерапевтов.
Алгоритм диагностики при запоре
Лабораторная диагностика
Не достоверна. Применяется с целью дифференциальной диагностики причин запоров.
Дифференциальный диагноз
1. Необходимо проведение тщательного анализа «лекарственного» анамнеза и отмена препаратов, которые могут являться причиной запора.
4. Динамическая кишечная непроходимость может возникнуть вследствие раздражения брюшины в результате острого панкреатита или воспаления смежных органов (массивная пневмония, острый пиелонефрит).
5. Запоры могут быть вызваны электролитными нарушениями: гипокалиемия и гиперкальциемия (гиперпаратиреоз).
7. При наличии в анамнезе заболеваний анального канала (хроническая анальная трещина, длительное использование клизмы при запоре, боль в животе) возможно предположить синдром раздраженной кишки или болезнь Гиршпрунга с коротким сегментом.
8. При наличии длительного анамнеза обструктивного синдрома (особенно с диагностической лапаротомией или лапароскопией в прошлом) возможно предположить кишечную псевдообструкцию.
9. Внезапное начало запора в более старшем возрасте всегда должно наводить врача на мысль о раке толстой кишки.
Нарушение моторной функции кишечника может быть первичным и вторичным.
Первичные нарушения моторной функции толстой кишки:
— синдром раздраженной кишки с признаками спастической гиперкинезии толстой кишки;
— инертная толстая кишка с гипокинезией ;
— хроническая интестинальная псевдообструкция.
Вторичные моторные расстройства толстой кишки, сопровождающиеся запором, возникают при многих заболеваниях, которые приводят к гипер- или гипокинезии толстой кишки (по своим клиническим проявлениям они идентичны описанным выше первичным моторным расстройствам).
В соответствии с международными критериями, запор из-за гипокинезии кишки следует дифференцировать от затрудненной дефекации вследствие дисфункции тазового дна и запора при синдроме раздраженной кишки. Для этого применяют аноректальную манометрию, дефекографию и электромиографию.
Тревожные симптомы («красные флаги») при проведении дифференциальной диагностики:
— лихорадка;
— примесь крови в кале;
— прерывающие сон кишечные расстройства;
— похудание без явных причин;
— анемия;
— лейкоцитоз;
— ускорение СОЭ;
— изменение показателей биохимических и иммунологических проб;
— симптомы, впервые проявившиеся в возрасте старше 50 лет.
Осложнения
Затруднения при дефекации могут привести к существенному дискомфорту, спастическим болям в животе и чувству общего недомогания.
Острый запор или хронические эпизоды напряжения при дефекации могут вызвать острый или обострение хронического геморроя (характеризуется болью, зудом или кровотечением) или острый тромбоз геморроидальных вен.
Многими авторами оспаривается выше приведенный тезис о способности запора вызывать (провоцировать) геморрой и геморроидальный тромбоз. Тем не менее, после тщательного опроса, пациенты с данными заболеваниями часто рассказывают о затруднениях при дефекации в последнее время, чаще всего связанных именно с запором (связь с диареей прослеживается менее часто, за исключением пациенток в ранний период после родов).
Помимо этого, консервативное лечения геморроя будет более успешными, если исключены запоры в будущем.
Прохождение жесткого стула может привести к острой анальной трещине, которая является болезненным разрывом эпителиальноого слоя анального канала и может кровоточить. Регулярный твердый стул и болезненные спазмы ануса во время дефекации затрудняют процесс репарации тканей.
Запор может быть одной из причин повреждения тазового дна у женщин, конкурируя с частотой акушерских травм.
Хроническое воздействие (давление) твердого стула на переднюю стенку прямой кишки, как полагают, может явиться причиной одиночных ректальных язв. Как правило, это самокупирующийся процесс, хорошо отвечающий на лечение запоров. У взрослых может потребоваться диагностика доброкачественной одиночной ректальной язвы прямой кишки на предмет ее злокачественности.
Другие возможные осложнения запора:
Лечение
I. Основные принципы лечения запоров
1. Диетические рекомендации: коррекция рациона питания и водного баланса.
1.1 При гипомоторике. Показан рацион по типу «шлаковой нагрузки» при преимущественно сырые овощи, фрукты и ягоды в количестве не менее 200 г/сут., чернослив или курага по 8-12 ягод, бананы, яблоки, пшеничные отруби. Из рациона исключают: рисовую и манную каши, макаронные изделия, картофельное пюре, кисели, репу и редьку, щавель, молоко и шоколад, крепкий чай и кофе.
1.2 При гипермоторике (спастической дискинезии) показано более щадящее питание с отварными овощами, растительными жирами. Назначают пшеничные отруби с постепенным повышением дозы (с 2 чайных ложек до 3-6 столовых) до установления оптимальной. Важно соблюдать питьевой режим (не менее 1,5-2 литров в день).
2. Рекомендации по изменению образа жизни в соответствии с возрастом (необходимы регулярные физические нагрузки).
3. Лечение основного заболевания, вызвавшего запор.
4. Коррекция негативных медикаментозных влияний.
5. Физиотерапевтические процедуры (при отсутствии противопоказаний).
6. Нормализация моторной функции толстой кишки путем назначения препаратов, влияющих на моторику толстой кишки (прокинетики при гипокинезии или спазмолитики при гиперкинезии толстой кишки).
Предпосылкой для применения этих препаратов выступают патофизиологические механизмы, которые лежат в основе первичных моторных расстройств толстой кишки, связанных с дисбалансом в системе гастроинтестинальных гормонов – стимулирующих (гастрин, холецистокинин, энкефалины) и замедляющих (глюкагон, вазоактивный интестинальный полипептид, серотонин). Важным механизмом является изменение чувствительности рецепторного аппарата толстой кишки к различным стимулам.
Для замедления пропульсивной активности кишки используют спазмолитики, М-холиноблокаторы, опиаты, блокаторы кальциевых каналов и др.
При спастической (гипермоторной) дискинезии применяют миотропные спазмолитики:
— донаторы оксида азота;
— ингибиторы фосфодиэстеразы IV типа;
— блокаторы кальциевых каналов (селективные);
— блокаторы периферических серотониновых рецепторов;
— блокаторы натриевых каналов – мебеверин (дюспаталин).
7. Использование препараты слабительного действия.
Выбор слабительного средства осуществляется в зависимости от ведущего патологического механизма запора. При сложном механизме расстройства моторики целесообразно назначение комбинации препаратов с разным механизмом действия. Также целесообразна смена препарата и дозы в процессе лечения в связи с развитием привыкания, повышением чувствительности рецепторов к восприятию двигательных стимулов.
В зависимости от эффекта следует изменять ритм приема слабительных и их дозу, делать перерывы в приеме.
Поскольку использование слабительных приводит к потере электролитов, нарушению синтеза витаминов группы, необходимо учитывать исходное состояние пациента (возраст, сопутствующие заболевания, состояние электролитного баланса).
Группы слабительных препаратов
1. Увеличивающие объем кишечного содержимого:
— содержащие растительные волокна и гидрофильные волокна;
— отруби;
— морская капуста (ламинария), льняное семя, семя подорожника, агар-агар, препараты метилцеллюлозы, мукофальк 10-15 г/сут.
2. Осмотические слабительные: солевые, форлакс (полиэтиленгликоль с молекулярной массой 4000), сульфат магния, сульфат натрия, сорбитол, маннитол, лактулоза, лактитол (экспортал).
3. Размягчающие фекалии: вазелиновое, касторовое, миндальное и др. масла, парафин.
4. Средства, стимулирующие функцию кишечника:
— антрагликозиды: ревень, крушина, препараты сенны;
— гуталакс, бисакодил, дульколакс;
— травяные слабительные сборы в различных комбинациях: плоды тмина, кора апельсина, кора крушины, плоды бузины черной, плоды тостера, листья сенны, листья мяты, семена укропа, цветы ромашки, цветы бессмертника, корень валерианы).
Синдром раздраженного кишечника у детей: основные причины и подходы к терапии
Синдром раздраженного кишечника (СРК) является самым распространенным функциональным заболеванием кишечника у взрослых и представляет значимую социальную проблему, влияя на качество жизни. В основе развития СРК лежит взаимодействие двух основных патогенетических механизмов: психосоциального воздействия и нарушения моторной функции толстой кишки, что проявляется повышением висцеральной чувствительности и изменением двигательной активности кишки.
В развитие заболевания имеют значение личностные и психологические аспекты, генетическая предрасположенность, факторы питания, изменение висцеральной гиперчувствительности, нарушения моторной активности и нейроэндокринной системы (ось «головной мозг — кишечник»), повышение проницаемости кишки, нарушение состава кишечной микробиоты. Качественные и количественные изменения микрофлоры оказывают влияние на функцию кишечника, выступая в качестве причины нарушений его двигательной активности, чувствительности и нейроиммунных взаимоотношений, включая нарушение экспрессии рецепторов слизистой оболочки и изменения функции гипоталамо-гипофизарно-надпочечниковой системы. В педиатрической практике возможности использования медикаментозных препаратов значительно ограничены возрастом пациентов. В терапии предпочтение необходимо отдавать селективным препаратам, влияющим на висцеральную чувствительность и пробиотикам с доказанной эффективностью и безопасностью штаммов.
Сведения об авторах:
Захарова Ирина Николаевна – д.м.н., профессор, заведующая кафедрой педиатрии им. Г.Н. Сперанского ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России; +7 (495) 496-52-38; e-mail: kafedra25@yandex.ru.
Сугян Нарине Григорьевна – кандидат медицинских наук, доцент кафедры педиатрии педиатрии им. Г.Н. Сперанского ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России;
Бережная Ирина Владимировна — кандидат медицинских наук, доцент кафедры педиатрии педиатрии им. Г.Н. Сперанского ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России.
Ключевые слова: дети, синдром раздраженной кишки, прокинетики, тримебутин, необутин, пробиотики, максилак.
Синдром раздраженного кишечника (СРК) является самым распространенным функциональным заболеванием кишечника у взрослых, представляя значимую социальную проблему с негативным влиянием на качество жизни. В большинстве стран мира частота встречаемости СРК составляет в среднем около 20%, варьируя от 9 до 48%. Мало информации о распространенности СРК у детей, например, в США по данным разных авторов частота составляет от 1,2 до 2,9% [1]. Оценить распространенность СРК в популяции трудно, т. к. статистические данные значимо различаются даже в разных регионах одной страны. Эпидемиологические показатели, обобщенные по данным опросников в разных странах мира, показывают, что чифры колеблются от 10 до 25%. По данным мета-анализа, суммарная распространенность заболевания оказалась около 11,2% (95% ДИ, 9,8–12,8) с различием в регионах земного шара: от самой низкой в Южной Азии (7%) до самой высокой в Южной Америке (21%). Показано, что первые несколько месяцев после установки диагноза «СРК» больные переносят до 4 атак с выраженной болью в животе. В дальнейшем у 30–40% увеличиваются светлые промежутки между обострениями. Примерно у половины пациентов с СРК (45%) развиваются хронические заболевания верхних отделов ЖКТ (диспепсия, хронический гастрит, ГЭРБ и др.) через несколько лет течения СРК.
Функциональные нарушения ЖКТ одна из самых загадочных проблем современной медицины, так как, несмотря на огромный спектр диагностических процедур, до конца понять этиологию и патогенез не представляется возможным. Уже около 30 лет мы используем клинические рекомендации, известные под названием Римские критерии. В 2016 году вышла новая редакция клинических рекомендаций функциональных нарушений ЖКТ – Рим IV, в которые входят разделы функциональных гастроинтестинальных расстройств ФГИР) у взрослых, детей и подростков. Появившаяся доказательная база в течение последних 10 лет обеспечила основу для рекомендаций «Рим IV пересмотра». При некоторых расстройствах органов пищеварения комитет использовал клинический опыт и консенсус членов комитета, все еще не имея достоверных научных данных, для этих разделов. В научной литературе можно встретить разные интерпретации перевода «functional gastrointestinal disorders» — функциональные гастроинтестинальные расстройства (ФГИР), функциональные расстройства органов пищеварения (ФРОП) и другие. ФРОП более полно отражает проблему, так как консенсус охватывает функциональные нарушения верхних и нижних отделов ЖКТ и расстройства билиарного тракта.
В критериях Рима III подчеркивалось, что для установления функциональных нарушений нужно исключить органическое заболевание. В Римских критериях IV пересмотра фраза «нет доказательств в пользу воспалительного, анатомического, метаболического или неопластического процесса, объясняющего симптомы у субъекта» был удален из диагностических критериев [2]. Вместо этого добавлено «после соответствующего медицинского обследования, симптомы не могут быть отнесены к другому заболеванию». Это изменение позволяет выборочное обследование для подтверждения положительного диагноза ФРОП. Также отмечено, что ФРОП могут сосуществовать с другими органическими и хроническими воспалительными заболеваниями [3]. Точно так же у одного пациента могут быть разные ФРОП. В последней версии рекомендаций международного консенсуса Римские критерии-IV (Rome-IV), опубликованной в 2016 г., функциональные кишечные расстройства рассматриваются как спектр кишечных симптомов в 6 категориях, которые определяются как расстройства взаимодействия «кишка — головной мозг» («ЖКТ — ЦНС (центральная нервная система») (disorders of gut-brain interaction) [4].
В новую редакцию Римских критериев IV (2016) включены новые расстройства, это функциональная тошнота и функциональная рвота. Изменена формулировка «боль в животе, связанная с функциональными желудочно-кишечными расстройствами» на «функциональные абдоминальные болевые расстройства». В эту группу внесен новый термин — функциональная абдоминальная боль (иным образом «FAP-NOS») для описания детей абдоминальной болью, диагностические критерии которых недостаточны для включения под определенное расстройство, например, СРК, функциональная диспепсия или абдоминальная мигрень.
Термин «дискомфорт» в новой редакции Римских критериях IV изъят из определения, поскольку сложно проводить грань между дискомфортом и абдоминальной болью у детей. Кроме того, как диагностический критерий, отсутствуют такие жалобы, как вздутие, растяжение или другие ощущения пациента [5].
В основе ФРОП лежат комбинированные физиологические и морфологические отклонения, связанные с висцеральной гиперчувствительностью, нарушениями моторики ЖКТ, защитного слизистого барьера, иммунной функции и состава кишечной микробиоты, а также расстройствами со стороны ЦНС.
В развитии ФРОП у детей в раннем возрасте немаловажную роль играют такие факторы, как морфофункциональная незрелость, недостаточная активность панкреатических и гастроинтестинальных ферментов, нарушение микробиоценоза, недостаточность мукозального иммунитета. В более старшем возрасте висцеральная гиперчувствительность обусловлена совокупностью факторов: социальными взаимоотношениями, стрессом, переутомлением, нарушением режима дня, отдыха.
В основе развития СРК лежит взаимодействие двух основных патогенетических механизмов: психосоциального воздействия и нарушения моторной функции толстой кишки, что проявляется повышением висцеральной чувствительности и нарушением двигательной функции кишки (таблица 1).
Таблица 1. Диагностические критерии СРК для детей (признаки должны присутствовать не менее 2 месяцев) [1].
Должны присутствовать следующие симптомы:
1. Абдоминальная боль не менее 4 дней в месяц, ассоциированная с 1 или более из следующих симптомов:
а. связано с дефекацией;
б. ассоциирована изменением частоты опорожнения;
c. ассоциирована с изменением формы (внешнего вида) стула.
2. При СРК с запором боль не проходит после опорожнения (если боль проходит после опорожнения, то у ребенка функциональный запор, а не СРК).
3. После соответствующей оценки симптомы не могут быть отнесены под другое заболевание.
Боль может быть различной интенсивности, локализуется, как правило, внизу живота, хотя может отмечаться и в других его отделах. Она часто усиливается при погрешностях в диете, психоэмоциональной нагрузке, переживаниях, также при физической нагрузке. Важно отметить, что абдоминальная боль исчезает в ночное время, когда ребенок спит.
Если боль проходит после опорожнения, то в этом случае, скорее всего, у ребенка имеет место функциональный запор, а не СРК с запором. Установлено, что у 75% детей, страдающих запором, присутствует абдоминальная боль, что подпадает под критерии СРК. Но и пациенты с СРК длительно наблюдаются с диагнозом функциональный запор не получая эффективной медицинской помощи. Комитет рекомендует пациентам с запором и абдоминальной болью на начальном этапе проводить лечение только от запора. Если боль в животе проходит после лечения запора, то у пациента функциональный запор. Если боль не проходит, вероятно, у ребенка имеет место СРК с запором. Аналогично, в случае возможного СРК с диареей. На первом этапе нужно исключить кишечную инфекцию с рецидивирующим, хроническим течением, целиакию, мальабсорбцию углеводов и реже воспалительное заболевание кишечника. Важно обратить внимание на тревожные сигналы («симптомы тревоги», «красные флаги»), при наличии которых нужно исключить органическую патологию органов ЖКТ. Указывается, что чем больше присутствует тревожных симптомов, тем выше вероятность органического заболевания (Таблица 2). Определение фекального кальпротектина все чаще используется как неинвазивный скрининг для исключения воспалительного заболевания кишечника (ВЗК) [6].
Таблица 2. Симптомы тревоги у пациентов с ФРОП.
| Семейный анамнез воспалительного заболевания кишечника, целиакии или язвенная болезнь; |
| Постоянная боль в правом верхнем или правом нижнем квадранте; |
| Дисфагия, одинофагия; |
| Рецидивирующая рвота; |
| Кровотечения из органов желудочно-кишечного тракта; |
| Ночная диарея; |
| Артрит; |
| Периректальные поражения; |
| Немотивированное похудание, потеря веса, недостаточность питания; |
| Задержка полового созревания; |
| Необъяснимая лихорадка; |
У детей, как и у взрослых, СРК можно разделить на разные типы, отражающие преобладающий характер стула (СРК с запор, СРК с диареей, СРК с запором и диарея и неуточненный СРК) и эти типы теперь включены в Рим IV [7].
Таблица 3. Функциональные расстройства органов пищеварения: нарушение взаимодействия ЖКТ и ЦНС по данным Римских критериев IV (коды Рим IV и МКБ-10).
С. Кишечные расстройства
С.1 Синдром раздраженного кишечника (СРК)
СРК с преобладанием запора (СРК-3)
СРК с преобладанием диареи (СРК-Д)
СРК смешанного типа (СРК-См)
Неклассифицируемый СРК (СРК-Н)
Формулировка
Коды Рим IV
МКБ-10
K59.0 запор
K58.2 Синдром раздраженного кишечника с преобладанием запоров
K59.1 Функциональная диарея
K58.1 Синдром раздраженного кишечника с преобладанием диареи
Функциональное абдоминальное вздутие/растяжение
R14 Метеоризм и родственные состояния
K59.9 Функциональное нарушение кишечника неуточненное
K58.8 Другой или неуточненный синдром раздраженного кишечника
Неспецифическое функциональное кишечное расстройство
K59.2 Неврогенная возбудимость кишечника, не классифицированная в других рубриках
K58.3 Синдром раздраженного кишечника со смешанными проявлениями
K59.0 Запор
Сложность этио-патогенеза заболевания у детей объясняется совокупностью факторов: личностные психологические аспекты, генетическая предрасположенность, факторы питания, развитие висцеральной гиперчувствительности, нарушения моторной активности, изменения в нейроэндокринной системе (ось «головной мозг — кишечник»), повышение проницаемости кишечника, нарушение состава кишечной микробиоты.
В научных исследованиях показано, что висцеральная гиперчувствительность может быть связана с детским психологическим стрессом (тревога, депрессия, импульсивность, гнев) [8].
У детей с СРК могут наблюдаться повышенный уровень стресса, беспокойства, депрессии и эмоциональных проблем, о которых они сообщают сами [9]. Тяжелые заболевания, требующие медицинского инвазивного вмешательства в раннем возрасте (например, операция) связаны с более высоким риском развития ФРОП у детей, включая СРК [10].
Патофизиология СРК включает воздействие внешних раздражающих факторов (стресс, высокая эмоциональная нагрузка, недостаток сна и т. д.), что возбуждает ЦНС, вегетативный ответ, с воздействием на нейроэндокринную систему кишечника, включая гипоталамо-гипофизарно-надпочечниковую (кортизол) систему. Это нарушает двигательную активность кишечника, усиливает спазм гладкой мускулатуры, нарушает пассаж кишечного содержимого. С другой стороны, изменения двигательной активности кишечника приводят к перевозбуждению внутрикишечных нервных волокон, клеток Кахаля, усиливая спазм гладких мышц, изменяется микробиота, что влияет на среду и синтез КЖК. Таким образом, возникает порочный круг (таблица 4).
Таблица 4. Патофизиология развития СРК: связь «головной мозг – кишка» [11].
Нарушение функционирования оси «головной мозг – кишка»
Кортикотропин-релизинг-фактор (CRF)
Активация энтеральной нервной системы
Изменение микробиоты
Активирует CRF-1 рецепторы → усиление моторики при стрессе
Провоспалительная активность → увеличение синтеза ИЛ-1 и ИЛ-2
Усиление ответа на эндотоксины
Повышение уровня кортизола и адреналина
Повышение сенситивности кишечных нервов
Нейротрансмиттеров → нарушение перистальтики
Повышенная дегрануляция тучных клеток → нарушение серотонинового сигнального каскада
Дисбаланс синтеза провоспалительных и воспалительных медиаторов
Повышение проницаемости кишечного барьера
Нарушение местного иммунитета
Экспрессия синтеза нейротрансмиттеров
(серотонин, ГАМК, гистамин, ацетилхолин, мелатонин и др.)
Нарушение слизистого барьера
и микробной биопленки
Модуляция кишечной чувствительности
афферентных волокон
Часто СРК развивается после перенесенной острой кишечной инфекции, отмечено повышение содержания провоспалительных цитокинов в слизистой оболочке ЖКТ и развивается постинфекционный СРК [12]. Систематический обзор, опубликованный в 2015 году, показал частоту регистрации постинфекционной функциональной диспепсии и СРК в популяции, включая детей 10,0% (ФД, n = 976; ОГЭ, n = 9737) и 13,1% (СРК, n = 1128; ОГЭ, n = 8624), соответственно. Так же указано длительное сохранение расстройств, установлено, что через 1 год после перенесенного о. гастроэнтерита постинфекционная функциональная диспепсия сохранилась у 13,5 % пациентов (n = 380; ОГЭ n = 2807) и синдром раздраженной кишки у 38,9% детей (n = 86 ; ОГЭ n = 221) [13].
В другом исследовании указана роль паразитарной инфекции (Balantidiumcoli, Strongyloidesstercoralis, Ascarislumbricoides, Necatoramericanus, Ancylostomaduodenale, Taeniasolium, Taeniasaginataи Hymenolepisnana) в развитии постинфекционных ФРОП, в частности в развитии СРК (OР составил: 1,69), функционального запора (Oр: 4,13) [14].
Роли кишечной микробиоты в патофизиологии СРК в настоящее время посвящено большое количество экспериментальных и клинических исследований. Были продемонстрированы изменения в микробиоме кишечника, хотя неясно, являются ли эти изменения причиной или результатом СРК и его симптомов [15].
Установлено, что качественные и количественные изменения микрофлоры оказывают влияние на функцию кишечника, выступая в качестве причины нарушений его двигательной активности, чувствительности и нейроиммунных взаимоотношений, включая нарушение экспрессии рецепторов слизистой оболочки и изменения функции гипоталамо-гипофизарно-надпочечниковой системы. Известно, что кишечная микрофлора утилизирует нерастворимые углеводы и выделяются метаболиты, среди них важное значение имеют короткоцепочечные жирные кислоты (уксусная, пропионовая и масляная кислоты). Именно эти короткоцепочечные жирные кислоты (КЦЖК) в разных отделах толстой кишки оказывают противоположное влияние на моторную ее активность, через стимуляцию определенных рецепторов, вырабатывающих биологически активные вещества. В проксимальных отделах толстой кишки КЦЖК стимулируют рецепторы L-клеток, которые вырабатывают регуляторный полипептид PYY, замедляющий двигательную активность не только толстой, но и тонкой кишки. А в дистальных отделах КЦЖК стимулируют рецепторы Ecl-клеток, вырабатывающих гистамин, который, действуя на 5-HT 4-рецепторы афферентных волокон блуждающего нерва, инициирует рефлекторное ускорение моторики. Среди КЦЖК, важное значение для колоноцитов имеет масляная кислота (бутират), которая является важнейшим энергетическим источником для колоноцитов, синтеза липидов мембран, защитного барьера и проницаемости слизистой оболочки толстой кишки, подавления окислительного стресса, воспаления, колоректального канцерогенеза, восстановления водно-электролитного баланса. Кроме этого, масляная кислота (бутират) оказывает регулирующее влияние на кишечную моторику [16].S.A.Vanhoutvin с соавт. изучали влияние масляной кислоты (бутирата) на висцеральную гиперчувствительность у здоровых добровольцев. Участникам исследования ректально вводили масляную кислоту. Результаты исследования показали, что введение масляной кислоты повышало порог болевой чувствительности и снижало боль и дискомфорт, вызванные раздуванием ректального баллона, что оценивалось по аналоговой шкале. При этом отмечено, что введение бутирата имело дозозависимый эффект, чем выше была доза бутирата, тем больше снижалась висцеральная чувствительность [17].
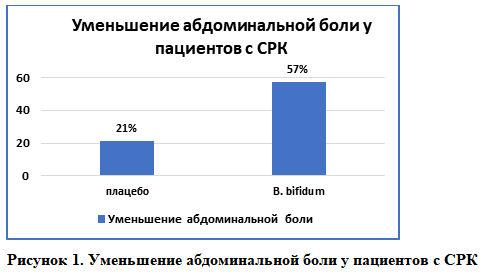
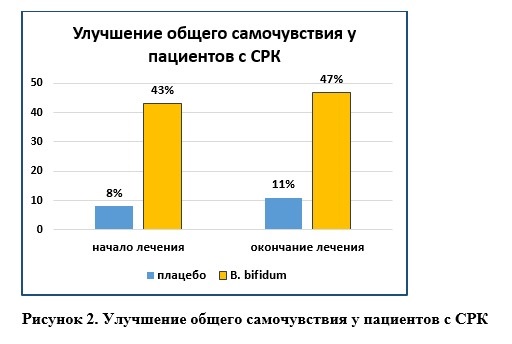
Применение одного из штаммов Bifidobacterium bifidum у пациентов с симптомами СРК приводило к значимому снижению таких симптомов как боль/дискомфорт в животе, метеоризм, нарушение пищеварения у 57% пациентов по сравнению с 21% в группе плацебо [19].
В метаанализе проводилась оценка результатов 24 клинических исследований с участием 2001 пациентов с СРК. Результаты анализа показали достоверное уменьшение симптомов боли и общих симптомов у пациентов при применении мультиштаммовых пробиотиков. Мультиштаммовые пробиотики оценивались в 12 РКИ с участием 1197 пациентов со значительным влиянием на симптом абдоминальной боли (ОР = 0,81; 95% ДИ 0,67–0,98, р 8 КОЕ, а также пребиотический компонент фруктоолигосахарид. Инновационная капсула DRcaps™, в свою очередь, нейтрализует негативное воздействие кислого содержимого желудка, солей желчных кислот и пищеварительных ферментов.
Ведущую роль в структуре абдоминального болевого синдрома наиболее часто играет спастическая висцеральная боль, в основе которой лежит непроизвольное сокращение гладких мышц кишечника, не сопровождающееся их немедленным расслаблением. Селективные миотропные спазмолитики имеют возрастные ограничения у детей. По клинической эффективности тримебутин сопоставим с такими спазмолитиками, как пинаверия бромид и мебеверин в терапии боли в животе при СРК у взрослых [27].
Проведена сравнительная оценка эффективности терапии препаратами, координирующими моторику кишечника (тримебутин) как монотерапии, так и в комбинации с пробиотиками у детей в возрасте 5-17 лет с симптомами СРК. В первой группе (n=15) проводилась терапия тримебутином в возрастной дозировке курсом 1 месяц, во второй группе (n=15) проводилась комбинированная терапия тримебутин + пробиотики. Авторы определяли уровень фекального кальпротектина (белка, отражающего выраженность воспалительного процесса), как показателя воспаления в кишечнике. Уровень кальпротектина у пациентов с СРК был исходно повышен у 27,3% детей, средний уровень показателя превышал нормальные показатели в 2 раза.
Полученные результаты показали высокую эффективность тримебутина (у 82% детей) при монотерапии, и наилучший результат (до 98%) при комбинации тримебутина с пробиотиком. В группе плацебо купирование абдоминальной боли наблюдалось у 22 % детей. Нормализация стула у 99% детей второй группы и 15% группы плацебо [29].
В другом исследовании оценивали распространенность СРК у детей и эффективность тримебутина в коррекции клинической симптоматики. Были включены 345 детей и подростков от 4-18 лет. Распространенность СРК в соответствии с критериями Рима III у детей и подростков составила 22,6%, причем преобладающим подтипом был СРК с запором. 78 детей и подростков с нормальными лабораторными показателями и установленным диагнозом СРК были рандомизированы на две группы: 39 пациентов получали тримебутин 300 мг в сутки три недели, 39 пациентов не получали медикаментозного лечения. Клиническое улучшение наблюдалось у 94,9% пациентов, принимавших тримебутин против 20,5% в группе, не применявшей медикаментозное лечение (P