код мкб гиперплазия предстательной железы у мужчин
Доброкачественная гиперплазия предстательной железы (аденома простаты)
Доброкачественная гиперплазия предстательной железы (аденома простаты) — одно из самых распространенных заболеваний у мужчин пожилого возраста, характеризующееся разрастанием ткани предстательной железы и приводящее к нарушению мочеиспускания. В возрасте около 50 лет оно имеет место у 50% мужчин, старше 60 лет — у 60%; у мужчин старше 70 лет аденома простаты диагностируется в 70–80% случаев.
Аденома простаты (ДГПЖ)
Доброкачественная гиперплазия предстательной железы — одно из самых распространенных заболеваний у мужчин пожилого возраста, 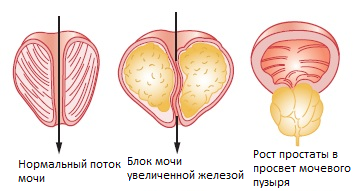
Причины доброкачественной гиперплазии простаты
Главными причинами развития аденомы простаты являются:
Симптомы доброкачественной гиперплазии простаты
1. Затрудненное, вялой струей мочеиспускание
2. Задержка начала мочеиспускания
3. Чувство неполного опорожнения мочевого пузыря, заставляющее вас напрягаться в конце мочеиспускания
4. Учащенное дневное и ночное мочеиспускание (более 2 раз за ночь)
5. Частые, трудно сдерживаемые позывы к мочеиспусканию
6. Подкапывание мочи в конце мочеиспускания
Диагностика доброкачественной гиперплазии простаты
Для достоверного подтверждения ДГПЖ, вам будет необходимо провести ряд лабораторно-инструментальных исследований:
Лечение доброкачественной гиперплазии простаты
В случае, если консервативная (медикаментозная) терапия гиперплазии простаты оказалась неэффективной, вам будет предложено хирургическое лечение аденомы простаты. Золотым стандартом лечения ДГПЖ является:
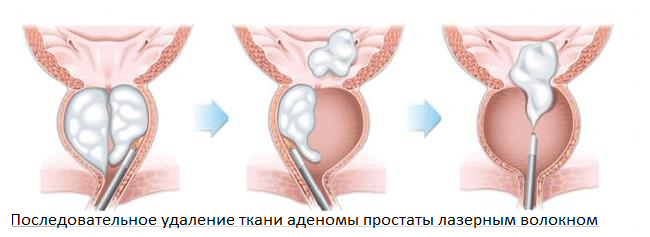
При помощи специального инструмента с камерой на конце, который проводится через мочеиспускательный канал в мочевой пузырь, обнаруживается аденоматозная ткань простаты. В пределах капсулы ДГПЖ производится удаление тканей. Эта манипуляция может осуществляться при помощи как электрической, так и лазерной энергии. На базе нашей клиники было исследовано и внедрено в практику уникальное высокоэффективное тулиевое лазерное волокно, которое позволяет одновременно удалить аденоматозную ткань и безопасно коагулировать (прижигать) кровоточащие сосуды. Данная операция получила название Тулиевой волоконной лазерной энуклеации аденомы простаты.
Благодаря разработанным в нашей клинике параметрам лазерной энуклеации достигаются следующие преимущества данного оперативного пособия:
Данная операция возможна даже при больших объемах предстательной железы. Однако, в случае, если объем органа превышает 220-300мл, вам может быть предложено открытое (лапароскопическое или роботассистированное) оперативное вмешательство. Выбор того или иного метода зависит не от желания пациента или врача, а от данных полноценного обследования и оценки всех возможных рисков. Это позволяет вам вместе с лечащим врачом и хирургом выбрать оптимальный для вас метод лечения гиперплазии простаты.
Если у вас возникли дополнительные вопросы по данному заболеванию, то можете связаться с нами онлайн или по телефону, указанному в шапке профиля, а также записаться на консультацию к одному из наших специалистов.
Перед госпитализацией Вам будет предложено высококачественное обследование в полном объеме в стенах нашей клиники.
Также вы можете познакомиться с сотрудниками нашего отделения, которые специализируются на хирургическом лечении гиперплазии простаты:
Рапопорт Л.М.
Диагностика и лечение доброкачественной гиперплазии предстательной железы
Доброкачественная гиперплазия предстательной железы (ДГПЖ) распространена настолько, что многие исследователи говорят о неизбежности этого состояния у мужчин. К 80 годам 80% мужчин страдают этим недугом. Этиология заболевания изучена недостаточно. Впервы
Доброкачественная гиперплазия предстательной железы (ДГПЖ) распространена настолько, что многие исследователи говорят о неизбежности этого состояния у мужчин. К 80 годам 80% мужчин страдают этим недугом. Этиология заболевания изучена недостаточно. Впервые ДГПЖ проявляется гистологически у мужчин старше 40 лет появлением стромальных узелков в периуретральной области переходной зоны простаты. За узлообразованием следует непосредственно железистая гиперплазия [5, 6].
Клинически данное заболевание проявляется различными симптомами, связанными с нарушением пассажа мочи по нижним мочевым путям. Причинами нарушения мочеиспускания являются инфравезикальная обструкция и ослабление функции детрузора. В основе обструкции лежит увеличение простаты в размерах с постепенным сужением просвета мочеиспускательного канала (механический компонент) и повышением тонуса гладкомышечных волокон простаты и задней уретры (динамический компонент) [6].
У части пожилых мужчин с ДГПЖ вторичные структурно-функциональные изменения детрузора обструктивного характера усугубляются стрессорными (прямое катехоламиновое воздействие) и ишемическими (спазм сосудов) повреждениями гладкомышечных элементов мочевого пузыря.
Эфферентным звеном стресс-реакции являются соответствующие волокна симпатических нервов и адренорецепторы. В этих случаях мочевой пузырь испытывает повышенное воздействие катехоламинов и, как следствие этого процесса, возникают расстройства биоэнергетики и функции детрузора [6, 7]. Качество мочеиспускания начинает все более ухудшаться, что заставляет пациентов обращаться за медицинской помощью.
«Золотым стандартом» лечения ДГПЖ во всем мире является трансуретральная резекция предстательной железы. Тем не менее терапия расстройств мочеиспускания, обусловленных ДГПЖ, в последние годы находит все более широкое применение. С одной стороны, это связано с появлением новых лекарственных препаратов, а с другой — с расширением показаний к медикаментозной терапии и одновременной возможностью наблюдения за больными.
Учитывая многообразие доступных на данный момент способов медикаментозной терапии, большую актуальность имеет вопрос формулировки показаний и выбор препарата для ее проведения.
Для принятия решения о целесообразности медикаментозной терапии ДГПЖ все пациенты должны пройти соответствующее предварительное обследование.
Современные методы диагностики заболевания характеризуются минимальной инвазивностью и высокой точностью. Исследования, проводимые у больных ДГПЖ, подразделяют на основные и уточняющие. К основным исследованиям относятся:
В соответствии с современной концепцией основные методы исследования должны не только точно диагностировать ДГПЖ и ее основные осложнения, но и выявлять факторы риска прогрессирования заболевания, к которым следует отнести:
Так, у мужчин с умеренными или выраженными симптомами гиперплазии простаты (IPSS > 7), сниженной максимальной скоростью мочеиспускания (Qmax 30 см 3 ) или повышенным (> 1,4 нг/мл) уровнем ПСА риск оперативного лечения приблизительно в 4 раза выше, чем у мужчин, не имеющих этих клинических признаков. Таким образом, любой из вышеупомянутых показателей определяет клиническую значимость заболевания и соответственно может быть показанием к назначению лечения (в ряде случаев — профилактического).
Применение уточняющих методов исследования представляется целесообразным в следующих случаях:
К уточняющим методам можно отнести как традиционные — ретроградную уретроцистографию, экскреторную урографию, комплексное уродинамическое исследование и уретроцистоскопию, так и относительно новые — трансректальную эхо-допплерографию, эхо-уродинамическое исследование, микционную мультиспиральную цистоуретрографию, магнитно-резонансную томографию (МРТ). Рассмотрим несколько подробнее возможности самых новых методов визуализации.
Трансректальная ультразвуковая допплерография простаты в первую очередь расширяет возможности диагностики рака предстательной железы. По полученным нами данным, специфичность (85%) и чувствительность (65%) этого метода при диагностике рака простаты выше, чем у обычного УЗИ [1–5, 9]. Кроме того, известные сегодня допплерографические факторы риска развития интраоперационных кровотечений позволяют планировать ход трансуретральных резекций простаты в зависимости от топического расположения избыточно васкуляризированных зон, определять показания к предоперационной подготовке (лечение ингибиторами 5α-редуктазы), направленной на снижение указанного риска ([4, 9].
Эхо-уродинамическое исследование позволяет без вмешательства в мочевые пути определить сократительную способность мышцы мочевого пузыря — детрузора, а также визуализировать шейку мочевого пузыря и простатический отдел уретры в момент мочеиспускания. Использование данной методики целесообразно для дифференциальной диагностики ДГПЖ и других причин нарушенного мочеиспускания, например гипотонии детрузора, стриктуры или камня уретры [1–3, 5].
В ходе микционной мультиспиральной цистоуретрографии с использованием мультиспирального компьютерного томографа визуализируются нижние мочевые пути во время мочеиспускания. Метод уникально информативен при выраженных изменениях анатомии нижних мочевых путей, в частности после оперативных вмешательств, что важно при планировании повторной операции. МРТ главным образом используется для распознавания и установления стадии рака простаты. В то же время информация, получаемая в результате МРТ, позволяет не только с высокой точностью диагностировать структурные изменения в простате, но и определять размеры и характер роста предстательной железы, что также важно при планировании оперативных вмешательств по поводу ДГПЖ, в особенности при повторных вмешательствах. При МРТ, однако, в отличие от мультиспиральной микционной цистоуретрографии нижние мочевые пути четко не визуализируются [4, 8].
Опыт применения современных диагностических методик у больных ДГПЖ показывает, что они позволяют установить диагноз гиперплазии простаты и распознать клинически значимые формы заболевания, выявить особенности гиперплазии, определяющие индивидуальный план лечения, рационально планировать оперативные вмешательства по поводу ДГПЖ, в том числе повторные, когда имеются выраженные изменения анатомии простаты и нижних мочевых путей.
В соответствии с клиническими рекомендациями Европейской ассоциации урологов актуальными целями лечения больных ДГПЖ являются:
Методы лечения больных ДГПЖ подразделяются на консервативные и оперативные. Консервативное ведение больного может быть медикаментозным или заключаться в динамическом наблюдении. При динамическом наблюдении пациент регулярно посещает врача без назначения какой-либо дополнительной терапии. По рекомендациям Европейской ассоциации урологов интервалы между посещениями и повторными обследованиями составляют приблизительно 1 год. Данный вид ведения больного допустим при незначительной (IPSS ё 7) и/или не доставляющей беспокойства симптоматике и при условии отсутствия абсолютных показаний к оперативному лечению.
Медикаментозная терапия — наиболее широко используемый метод лечения больных ДГПЖ. Именно появление современных лекарственных средств привело в 90-х годах прошлого века к существенному снижению числа операций по поводу данного заболевания.
Современные медикаментозные средства терапии ДГПЖ обладают высокой эффективностью и безопасностью, доказанными при многолетнем использовании. Сегодня наиболее изучены и широко используются в клинической практике препараты трех групп:
Помимо способности уменьшать степень выраженности симптомов и улучшать объективные параметры мочеиспускания, каждая группа препаратов обладает рядом свойств, определяющих дополнительные показания к их применению.
Так, установлено, что α1-адреноблокаторы являются наиболее быстро действующими препаратами — эффект от их применения развивается уже через 5–10 дней. В то же время в ходе клинических исследований установлено, что доксазозин (Кардура) и тамсулозин (Омник) эффективны как при острой задержке мочи, так и в профилактике послеоперационной ишурии. Теразозин, доксазозин и альфузозин способны снижать артериальное давление при сопутствующей артериальной гипертензии, а тамсулозин позволяет улучшить показатели сердечной деятельности у больных ДГПЖ с сопутствующей ИБС.
Ингибиторы 5α-редуктазы не только способствуют уменьшению размеров предстательной железы (в среднем на 30%), но и эффективны при макрогематурии, обусловленной гиперплазией простаты, а также снижают интраоперационную кровопотерю (при использовании препаратов в порядке подготовки к трансуретральной резекции простаты).
В ходе исследования PCPT (Prostate Cancer Prevention Trial) установлено, что прием ингибитора 5α-редуктазы финастерида снижает риск развития рака простаты на 25%. Не менее авторитетное исследование MTOPS (Medical Treatment Of Prostatic Symptoms) показало, что монотерапия ингибитором 5a-редуктазы финастеридом (Финаст) снижает риск прогрессирования ДГПЖ в 2 раза, а при его сочетании с α1-адреноблокатором — на 67%.
Таким образом, было доказано, что комбинированное лечение ингибитором 5α-редуктазы и α1-адреноблокатором может быть целесообразным с точки зрения не только более быстрого ослабления расстройств мочеиспускания, но и предотвращения развития осложнений ДГПЖ (например, острой задержки мочи).
Из растительных препаратов наиболее глубоко изучен экстракт Serenoa repens (Пермиксон, Простамол уно), который также обладает способностью уменьшать объем гиперплазированной простаты (в среднем на 20%). Данные клинических исследований свидетельствуют о том, что указанный экстракт обладает противовоспалительной и противоотечной активностью, что делает целесообразным его назначение больным ДГПЖ при сопутствующем простатите.
Нельзя не отметить, что современный подход к выработке лечебной тактики у больных гиперплазией простаты предусматривает активное участие пациента в этом процессе. В связи с этим задача врача — подробно информировать пациента о заболевании и сопряженных с ним рисках, преимуществах и недостатках различных вариантов лечения, особенностях лечения в данном конкретном случае. Целесообразность подобного подхода диктуется тем, что когда речь идет о качестве жизни, никто лучше пациента не способен определить, что для него наиболее значимо как в самом заболевании, так и в способах его лечения. В результате вид лечения определяется не только исходя из индивидуальных особенностей заболевания, но и с учетом личных предпочтений больного.
При соблюдении указанных принципов медикаментозная терапия высокоэффективна. Перспективы дальнейшего развития данного направления в лечении ДГПЖ огромны и базируются на успехах современной медицинской науки.
Литература
Ю. Г. Аляев, доктор медицинский наук, профессор, член-корреспондент РАМН
В. А. Григорян, доктор медицинский наук, профессор
Д. В. Чиненов, кандидат медицинский наук
ММА им. И. М. Сеченова, Москва
Морфологическая характеристика ткани гиперплазии предстательной железы при хроническом простатите
ВВЕДЕНИЕ
Доброкачественная гиперплазия предстательной железы (ДГПЖ) – широко распространенное полиэтиологическое заболевание среди стареющих мужчин, связанное с доброкачественным увеличением предстательной железы (ПЖ), характеризуется разрастанием периуретральной железистой ткани, обуславливающим обструкцию нижних мочевых путей [1].
Широкую распространенность ДГПЖ подчеркивает тот факт, что при гистологическом анализе ткани ПЖ гиперплазия регистрируется у 40% мужчин в возрасте 50 лет, более 50% – у мужчин 60 лет, и 90% – в возрасте 80 лет. Поэтому распространенность и клинические проявления ДГПЖ варьируют от 11,3% в возрастной группе 40–49 лет, 10 –15% среди мужчин после 50 лет, до 81,4% среди мужчин в возрасте 80 лет [2].
Немаловажное значение в запуске пролиферативных процессов в ткани ПЖ и их прогрессировании имеют инфекционно-воспалительные процессы в ткани [3, 4]. Ухудшение кровоснабжения гиперплазированной ПЖ ведет к развитию неспецифического воспалительного процесса, который по современным представлениям может играть важную патогенетическую роль в развитии хронического простатита [4, 5], что, в свою очередь, ведет к прогрессированию ДГПЖ и снижению эффективности медикаментозной терапии 6.
Хроническое воспаление ПЖ традиционно считалось заболеванием молодых мужчин, однако среди пациентов старшего возраста данная нозология довольно широко распространена [8]. Так, у мужчин в возрасте до 50 лет частота подтвержденного простатита всего только в два раза выше, чем у мужчин старше 50 лет [9, 10]. При этом среди мужчин старшей возрастной группы достаточно часто простатит сочетается с ДГПЖ. Результаты обширного исследования показали, что 57,2% больных хроническим простатитом имели ГПЖ, а 38,7% пациентов с ДГПЖ – хронический простатит [11]. При исследовании биоптатов гиперплазированной ПЖ гистологические признаки хронического простатита выявили в 81% случаев, из них в 80% признаки воспаления были умеренными, а в 20% – сильно выраженными [12]. По данным G. Gandaglia и соавт. у 40-70% пациентов с ДГПЖ выявляется хронический простатит, который приводит к развитию симптомов нарушения функции мочевых путей (СНМП) [13].
Ряд исследователей указывает на роль воспаления в увеличении ПЖ и развитии ДГПЖ. Наличие хронического воспаления в ткани ПЖ приводит значительному ухудшению течения метаболических процессов в железе и ускоряет процессы пролиферации в ткани железы, что ведет к прогрессивному ее росту [14, 15, 16]. Во многом это связано с секреторной активностью клеток воспаления, инфильтрирующих гиперплазированную ПЖ, в частности Т-лимфоцитов [17]. Часто при гистологическом исследовании биоптата или удаленной ПЖ в гиперплазированной ткани железы выявляют гистиолимфоцитарную инфильтрацию. Некоторые представители лимфоцитарного звена характеризуются способностью стимулировать клеточную пролиферацию за счет секреции комплекса провоспалительных цитокинов, в частности интерлейкинов 6, 8, 21, а также факторов роста, в том числе фактор роста фибробластов. Показано, что при наличии инфекционно-воспалительного процесса в ПЖ продукция этих факторов значительно возрастает, что может существенно ускорять процессы пролиферации в ткани ПЖ [16, 18, 19].
Доказана связь между воспалением ПЖ, выявленным при гистологическом исследовании, и увеличением ее объема, а также усилением тяжести СНМП вплоть до развития острой задержки мочи [3, 20, 21].
В связи с этим мы посчитали целесообразным провести сравнительный анализ морфологических изменений гиперплазированной ткани ПЖ при хроническом простатите при различных методах хирургического лечения ДГПЖ.
МАТЕРИАЛЫ И МЕТОДЫ
Морфологическое исследование проводилось на материале, полученном при резекции ПЖ у больных с ДГПЖ. Материал получен от 276 пациентов. Пациенты были разделены на три группы: I группа (n=50) – больные, которым хирургическое лечение проводилось в объеме чрезпузырной аденоэктомии, II группа (n=76) – пациенты, которым выполнялась трансуретральная резекция ПЖ (ТУР ПЖ) и III группа (n=150) – мужчины, которым выполнялась энуклеация ПЖ с использованием гольмиевого лазера. Все три группы в зависимости от результатов гистологического исследования затем были разделены на подгруппы по наличию или отсутствию хронического воспаления в железе.
Фрагменты удаленной ткани ПЖ фиксировались нейтральным 10% формалином. Проводка выполнялась в автоматическом режиме на тканевом процессоре Donatello фирмы DIAPATH.
Из залитых в парафин по стандартной методике парафиновых блоков изготавливались парафиновые срезы толщиной 5 микрон и окрашивались гематоксилином и эозином в гистостейнере LST94 Linear Slide Stainer фирмы HESTION. Микроскопическое исследование проводилось с использованием светового микроскопа «Axioskop 40» фирмы ZEISS (окуляр х 10, объективы х 5, х 10, х 20, х 40, 100). Проводилась оценка общего состояния ткани железы, размера железы, состояния ацинарного эпителия, изменений стромы, наличия и степени выраженности воспалительных инфильтратов, их клеточного состава.
При микроскопическом исследовании резецированной ткани шейки мочевого пузыря, проведенной и окрашенной аналогичным образом, оценивалось состояние уротелия, стромального и железистого компонентов, воспалительной инфильтрации.
С целью определения морфологических изменений в воспаленной ткани гиперплазированной ПЖ и их влияния на результаты оперативного лечения при использовании различных методов операций мы провели анализ удаленной ткани железы, а также в случае развития осложнений, потребовавших повторных вмешательств, ткани уретры и шейки мочевого пузыря.
РЕЗУЛЬТАТЫ
Морфология резецированной предстательной железы
При анализе морфологической картины резецированной гиперплазированной ткани ПЖ, если гиперплазия ПЖ сочеталась с хроническим бактериальным воспалением, регистрировалась выраженная лимфоплазмоцитарная инфильтрация ткани ПЖ. При гистологическом анализе обнаруживалось, что ПЖ деформированы и (или) частично разрушены клетками воспалительного инфильтрата. Отмечались лимфо-гистиоцитарные инфильтраты вокруг измененных ацинусов. Практически у всех исследованных пациентов фиксировалась деформация ПЖ (рис. 1).
Рис.1. Лимфоплазмоцитарный инфильтрат вокруг предстательной железы. Окр. гематоксилином и эозином. Увеличение 100
Fig. 1. Lymphoplasmacytic infiltrate around the prostate. Staining with hematoxylin and eosin. Magnification 100
На этом фоне отмечались очаги фиброза и склероза стромы. Мозаичность инфекционно-воспалительных инфильтратов и склеротических изменений существенно отягощало состояние микроциркуляторного русла. Кроме того, фиксировалось преобладание рубцовых процессов в ткани ПЖ, с общим выраженным нарушением анатомического строения долек органа (рис. 2).
Рис. 2. Склеротические процессы в ткани ПЖ с выраженным нарушением анатомического строения долек органа на фоне хронического воспаления. Окр. гематоксилином и эозином. Увеличение 100
Fig. 2. Sclerotic processes in the prostate tissue with a pronounced violation of the anatomical structure of the lobules of the organ against the background of chronic inflammation. Staining with hematoxylin and eosin. Magnification 100
Также на фоне склеротических изменений и хронического воспаления отмечалось нарушение сосудистой архитектоники органа, а в некоторых участках на фоне выраженного воспаления – ее полное отсутствие. Ишемизированная ткань, в сочетании с хроническим воспалением, возможно, является причиной таких грозных осложнений, как склероз шейки мочевого пузыря. При этом на фоне фрагментации капиллярной сети встречались бессосудистые зоны. Чаще всего данной фрагментации и редукции подвержены сосуды микроциркуляторного русла с малым диаметром, которые отвечают за питание ткани ПЖ. Вследствие поражения питающих капилляров усугубляется развитие как фиброза ткани ПЖ, так и нарушение гемодинамики органа, которая имеет главенствующее значение не только в патогенезе гиперплазии ПЖ, но и существенно влияет, на результаты ее хирургического лечения (рис. 3).
Рис.3. Хроническое воспаление и гиперплазия ткани предстательной железы. Фрагментации капиллярной сети и бессосудистые зоны. Окр. гематоксилином и эозином. Увеличение 200
Fig. 3. Chronic inflammation and hyperplasia of the prostate tissue. Fragmentation of the capillary network and avascular zones. Staining with hematoxylin and eosin. Magnification 200
Таким образом, у большинства пациентов с ДГПЖ при гистологическом исследовании отмечается лимфоплазмоцитарная реакция разной степени выраженности, которая вызывает анатомические нарушения, ухудшение микроциркуляции в органе, особенно при длительно существующем воспалительном процессе, способствующем склерозированию органа и обеднению сосудистого русла, что существенно повышает риск развития послеоперационных осложнений, требующих длительной консервативной терапии, а иногда и повторных оперативных вмешательств. Эти изменения могут иметь различную степень негативного влияния при использовании разных методов оперативного лечения.
Гистологическое изучение материала ткани ПЖ, полученной при трансуретральной резекции, выполненной по поводу развившихся осложнений после чрезпузырной аденомэктомии на фоне хронического воспаления, показало, что в ней выявляли массивные воспалительные инфильтраты с развитием грануляционной ткани. При этом отмечалось наличие развитие хронического продуктивного воспаления, развивающегося вокруг ацинусов и протоков. Также отмечалась гистоструктурная перестройка ткани ПЖ, с преобладанием склеротических и дегенеративно-дистрофических изменений (рис. 4).
Рис. 4. Резко выраженное хроническое воспаление с развитием грануляционной ткани, отек и склероз стромы после чрезпузырной аденомэктомии у пациента с ДГПЖ, ассоциированной с хроническим бактериальным простатитом. Окраска гематоксилином и эозином. Ув. 100
Fig. 4. Severe chronic inflammation with the development of granulation tissue, edema and sclerosis of the stroma after transvesical adenomectomy in a patient with BPH associated with chronic bacterial prostatitis. Staining with hematoxylin and eosin. Magnification 100
Морфологические изменения предстательной железы после чрезпузырной аденомэктимии
При морфологическом исследовании резецированной ткани ПЖ после чрезпузырной аденомэктомии на фоне хронического воспаления отмечается кистозное расширение сохранившейся ткани ПЖ в периферической зоне, атрофия ацинарного эпителия и очаговая плоскоклеточная метаплазия, выраженный склероз стромы, выраженное хроническое воспаление и полнокровие (рис. 5).
Рис. 5. Кистозное расширение оставшейся ткани ПЖ в периферической зоне, очаговая плоскоклеточная метаплазия эпителия. Окраска гематоксилином и эозином. Увеличение 200
Fig. 5. Cystic expansion of the remaining prostate tissue in the peripheral zone, focal squamous metaplasia of the epithelium. Staining with hematoxylin and eosin. Magnification 200
В ткани железы отмечается железистая и стромальная гиперплазия, плоскоклеточная, уротелиальная и базальноклеточная метаплазия с его частичной десквамацией, склероз стромы, лимфогистиоцитарная инфильтрация стромы (рис. 6).
Рис. 6. Чрезпузырная аденомэктомия при гиперплазии ПЖ, ассоциированной с хроническим бактериальным простатитом. Изменения в области простатической части уретры. Хроническое воспаление. Гиперплазия, плоскоклеточная метаплазия и десквамация уротелия. Окраска гематоксилином и эозином. Ув. 200.
Fig. 6. Transvesical adenomectomy for prostatic hyperplasia associated with chronic bacterial prostatitis. Changes in the area of the prostatic urethra. Chronic inflammation. Hyperplasia, squamous cell metaplasia and desquamation of the urothelium. Staining with hematoxylin and eosin. Magnification 200
Таким образом, на фоне сочетанного состояния гиперплазии ПЖ и хронического воспаления морфологическая картина характеризуется пестротой и варьирует от острого гнойного воспаления с большим количеством воспалительных инфильтратов, микроабсцессов до выраженного хронического лимфоплазмоцитарного воспаления вокруг ацинусов; а выполняемая чрезпузырная аденомэктомия, даже на фоне проводимой сочетанной антибактериальной терапии, способствует отеку и склерозу ткани ПЖ, нарушению гемодинамики и архитектоники органа. Данные обстоятельства снижают доступность воздействия противовоспалительных и антибактериальных фармакопрепаратов при их назначении таким больным. Кроме того, эта ситуация способствует развитию инфекционно-воспалительных осложнений в послеоперационном периоде.
Морфологические изменения предстательной железы после ТУР ПЖ
При анализе резецированной ткани после ТУР ПЖ на фоне сопутствующего хронического воспаления, в области операции выявляли зону коагуляционного некроза с геморрагической инфильтрацией в сочетании с воспалительной инфильтрацией стромы, что, возможно, является предпосылкой развития в послеоперационном периоде склероза шейки мочевого пузыря (рис. 7).
Рис. 7. Край резекции ПЖ при проведении ТУР ПЖ у пациента с ДГПЖ в сочетании с хроническим простатитом. Зона коагуляционного некроза и воспалительная инфильтрация по краю резекции. Окраска гематоксилином и эозином. Ув. 200.
Fig.7. Edge of prostate resection during TUR prostate in a patient with BPH in combination with chronic prostatitis. The area of coagulation necrosis and inflammatory infiltration along the resection margin. Staining with hematoxylin and eosin. Magnification 200
Кроме того, в резецированной ткани отмечались эктазия просвета сосудов, полнокровие, отек стромы, и, самое важное, дезорганизация коллагена (рис. 8)
Рис. 8. Ткань ПЖ после ТУР гиперплазированной ПЖ с сопутствующим хроническим простатитом. Эктазия просвета сосудов, полнокровие, отек стромы, дезорганизация коллагена. Окраска гематоксилином и эозином. Ув. 200
Fig. 8. Prostate tissue after TUR of hyperplastic prostate with concomitant chronic prostatitis. Ectasia of the lumen of blood vessels, plethora, edema of the stroma, disorganization of collagen. Staining with hematoxylin and eosin. Magnification 200
Коагуляционные тромбы в просвете сосудов микроциркуляторного русла вызывают ишемию ткани ПЖ. Коагуляционный некроз и ишемия ткани в сочетании с хроническим воспалительным процессом приводит в дальнейшем к фиброзной трансформации. Степень фиброза может варьировать от умеренной до резко выраженной и находится в прямой зависимости от степени ишемии и коагуляционного некроза (рис. 9).
Рис. 9. Трансуретральная резекция ПЖ. Выраженный фиброз стромы, полнокровие, гипертрофия мышечных волокон и элементы хронического воспаления. Окраска гематоксилином и эозином. Увеличение 100
Fig. 9. Transurethral resection of the prostate. Severe stromal fibrosis, plethora, hypertrophy of muscle fibers and elements of chronic inflammation. Staining with hematoxylin and eosin. Magnification 100
При оценке резецированной ткани ПЖ, когда ДГПЖ не сопровождалась воспалительным процессом, признаки нарушения процессов микроциркуляции в ткани железы в виде эктазии просвета сосудов, стаза эритроцитов и формирования тромбов, были выражены меньше, чем в предыдущей группе. Коагуляционные тромбы в просвете сосудов микроциркуляторного русла обнаруживались преимущественно в зоне оперативного вмешательства (рис. 10).
Рис. 10. Край резекции ПЖ после трансуретральной резекции гиперплазированной ПЖ. Коагуляционный некроз, геморрагическая инфильтрация и тромбы в сосудах в крае резекции простаты. Окраска гематоксилином и эозином. Увеличение 200
Fig. 10. Prostate resection margin after transurethral resection of the hyperplastic prostate. Coagulation necrosis, hemorrhagic infiltration and blood clots in the vessels at the edge of the prostate resection. Staining with hematoxylin and eosin. Magnification 200
Однако после трансуретральной резекции в ПЖ, даже при отсутствии фонового инфекционно-воспалительного процесса в ткани ПЖ, на фоне коагуляционного некроза отмечаются признаки асептического воспаления. Данное обстоятельство, при сочетании с нарушенной гемодинамикой, превалировании в ткани ПЖ стромального компартмента и снижении удельного веса железистой ткани также может служить предпосылкой и для развития склероза шейки мочевого пузыря (рис. 11).
Рис. 11. Край резекции ПЖ при ТУР гиперплазированной ПЖ без хронического воспаления. Преобладание стромального компонента, коагуляционный некроз по краю резекции. Окраска гематоксилином и эозином. Увеличение 200
Fig. 11. The edge of prostate resection during transurethral resection of the hyperplastic prostate without chronic inflammation. The predominance of the stromal component, coagulation necrosis along the edge of the resection. Staining with hematoxylin and eosin. Magnification 200
Морфологические изменения после лазерной энуклеации предстательной железы
Наиболее благоприятная морфологическая картина регистрируется при лазерной энуклеации гиперплазированной ткани ПЖ. При оценке удаленной ткани на фоне хронического воспаления ПЖ отмечались гипертрофия мышечных волокон и умеренные склеротические изменения. Кроме того, была выявлена умеренная гипертрофия мышечных волокон в ткани шейки мочевого пузыря, межмышечный склероз, полнокровие, десквамация уротелия. Признаки воспаления были минимальные. При этом не отмечали наличия коагуляционного некроза и нарушения микроциркуляторного русла. На наш взгляд, к важным факторам благоприятного прогноза можно отнести также отсутствие большого количества тромбов, способствующих развитию ишемии ткани железы, в просвете сосудов микроциркуляторного русла. Поэтому процессы миграции в этой зоне клеток фиброблатического звена минимальны (рис. 12).
Рис. 12. Лазерная энуклеация ткани ПЖ у пациента с сопутствующим хроническим простатитом. Склеротические изменения. Окраска гематоксилином и эозином. Увеличение 100
Fig. 12. Laser enucleation of prostate in a patient with concomitant chronic prostatitis. Sclerotic changes. Staining with hematoxylin and eosin. Magnification 100
При наличии в ткани ПЖ только гиперплазии, без инфекционно-воспалительной реакции, дистрофические процессы минимальны. Практически в резецированной ткани не отмечали воспалительных изменений, нарушения микроциркуляции, ишемии ткани и процессов склерозирования. Отмечалась умеренная гипертрофия мышечных волокон в ткани шейки мочевого пузыря и незначительный межмышечный склероз (рис. 13).
Рис. 13. Лазерная энуклеация ПЖ. Гипертрофия мышечных волокон в ткани шейки мочевого пузыря, межмышечный склероз. Признаки воспаления минимальные. Окраска гематоксилином и эозином. Увеличение 200.
Fig. 13. Laser enucleation of the prostate. Hypertrophy of muscle fibers in the tissue of the bladder neck, intermuscular sclerosis. The signs of inflammation are minimal. Staining with hematoxylin and eosin. Magnification 200
ОБСУЖДЕНИЕ
У большинства пациентов с ДГПЖ при гистологическом исследовании отмечается лимфоплазмоцитарная реакция разной степени выраженности, которая вызывает анатомические нарушения, ухудшение микроциркуляции в органе, особенно при длительно существующем воспалительном процессе, способствующем склерозированию органа и обеднению сосудистого русла, что существенно повышает риск развития послеоперационных осложнений, требующих длительной консервативной терапии, а иногда и повторных оперативных вмешательств. Эти изменения могут иметь различную степень негативного влияния при использовании разных методов оперативного лечения. Также на фоне склеротических изменений и хронического воспаления отмечалось нарушение сосудистой архитектоники органа, а в некоторых участках на фоне выраженного воспаления – ее полное отсутствие. Ишемизированная ткань, в сочетании с хроническим воспалением, является причиной таких осложнений, как склероз шейки мочевого пузыря. При этом на фоне фрагментации капиллярной сети встречались бессосудистые зоны. Чаще всего данной фрагментации и редукции подвержены сосуды микроциркуляторного русла с малым диаметром, которые отвечают за питание ткани ПЖ. Наиболее благоприятная морфологическая картина регистрируется при лазерной энуклеации гиперплазированной ткани ПЖ. При оценке удаленной ткани на фоне хронического воспаления ПЖ отмечались гипертрофия мышечных волокон и умеренные склеротические изменения. Кроме того, была выявлена умеренная гипертрофия мышечных волокон в ткани шейки мочевого пузыря, межмышечный склероз, полнокровие, десквамация уротелия. Признаки воспаления были минимальные.
ВЫВОДЫ
На фоне хронического инфекционно-воспалительного процесса и грубого рубцового процесса в ПЖ нарушается анатомия органа, а также архитектоника сосудов, что может приводить к снижению эффективности хирургического лечения. При сравнительном исследовании морфологической характеристики ПЖ при различных типах оперативных вмешательств, выявлено, что наименее выраженные изменения были выявлены после лазерной энуклеации гиперплазии предстательной железы.