Как правильно гасить азотную кислоту
Как правильно гасить азотную кислоту
Пользователь
Регистрация: 03.01.2007
Откуда: Беларусь
Сообщений: 996
В друзьях у: 4
Голосов: 98 / 4
Модератор
Регистрация: 08.01.2012
Откуда: Питер
Сообщений: 4188
В друзьях у: 4
Голосов: 358 / 40
Пользователь
Регистрация: 03.01.2007
Откуда: Беларусь
Сообщений: 996
В друзьях у: 4
Голосов: 98 / 4
Модератор
Регистрация: 08.01.2012
Откуда: Питер
Сообщений: 4188
В друзьях у: 4
Голосов: 358 / 40
Пользователь
Регистрация: 30.08.2012
Откуда: СПБ
Сообщений: 6854
В друзьях у: 22
Голосов: 1691 / 9
| Цитата |
|---|
| (Басма 19.05.2018 01:17:07) расход азотки на кило 250 пробы? Что то у меня получилось литра 4. |
Пользователь
Регистрация: 20.03.2011
Откуда: крым
Сообщений: 2395
В друзьях у: 9
Голосов: 159 / 6
Пользователь
Регистрация: 03.01.2007
Откуда: Беларусь
Сообщений: 996
В друзьях у: 4
Голосов: 98 / 4
| Цитата |
|---|
| (Olaf 19.05.2018 12:53:04) Да, что то многовато. Хотя расход зависит и от состава сплава, и от крепости кислоты. У меня на кило уходит примерно 1.5 литра |
Пользователь
Регистрация: 22.09.2009
Откуда: с Волги
Сообщений: 918
В друзьях у: 1
Голосов: 55 / 9
Пользователь
Регистрация: 30.08.2012
Откуда: СПБ
Сообщений: 6854
В друзьях у: 22
Голосов: 1691 / 9
Пользователь
Регистрация: 03.01.2007
Откуда: Беларусь
Сообщений: 996
В друзьях у: 4
Голосов: 98 / 4
Пользователь
Регистрация: 19.10.2010
Откуда: Челябинск
Сообщений: 5609
В друзьях у: 16
Голосов: 869 / 19
Пользователь
Регистрация: 13.06.2014
Откуда: Липецк
Сообщений: 1428
В друзьях у: 6
Голосов: 195 / 7
Модератор
Регистрация: 08.01.2012
Откуда: Питер
Сообщений: 4188
В друзьях у: 4
Голосов: 358 / 40
| Цитата |
|---|
| (ВитькОвский 20.05.2018 14:02:36) я понять не могу-сливайте раствор и все. |
Пользователь
Регистрация: 17.01.2015
Сообщений: 1371
В друзьях у: 4
Голосов: 59 / 13
Пользователь
Регистрация: 13.06.2014
Откуда: Липецк
Сообщений: 1428
В друзьях у: 6
Голосов: 195 / 7
Я вас умоляю 
Четыре кг кислоты это капля чистого в море грязное!
Вы пользуетесь мылом?стиральная машина есть?Пробовали считать сколько щелочи уходит в канализацию?
Кислота вся в трубах нейтрализуется+вы с экономите энергию которая пошла бы на производство пачки соды.
Форум химиков
как избавиться от азотной кислоты?
как избавиться от азотной кислоты?
Сообщение StYV » Пн ноя 07, 2005 6:22 pm
Re: как избавиться от азотной кислоты?
Сообщение Bolverk » Пн ноя 07, 2005 7:11 pm
Сообщение StYV » Пн ноя 07, 2005 7:47 pm
Сообщение Bolverk » Пн ноя 07, 2005 8:01 pm
Сообщение StYV » Пн ноя 07, 2005 8:26 pm
Re: как избавиться от азотной кислоты?
Сообщение avor » Пн ноя 07, 2005 9:05 pm
1. Странно, но никогда не слышал, чтобы азотка мешала опредению металлов, да и фосфора тоже вроде не сильно мешает.
2. Обычно азотку просто удаляют прокаливанием образцов.
3. Если вам не подходит прокаливание можно ее восстановить, например сульфиды восстанавливают азотку при нагревании, сами в основном превращаясь в серу, которая легко отделяется от раствора в виде осадка. Так же можно использовать легкоокисляемые органические вещества, например тот же формалин.
До аммиака вы загнули это нужен бешенный востановитель, чтобы из азотки получить аммиак, обычно дальше азота дело не заходит, а чаще всего образуются различные окислы наиболее стойкие закись и двуокись.
—А может на ионообменной колонке прогнать?
—-Это очень сложно для аналитики.
За чтоже вы так аналитику. Аналитика абсолютно не брезгает хроматографией вообще и ионообменной в частности.
А процедура то выглядит элементарно: На фильтре вроде Шотта промываете смолу АВ-17-8(любой анионообменник подойдет) промываете ее 1М солянкой потом водой потом 1М щелочью потом водой потом загружаете ее анионом вам нужным(например хлоридом или ацетатом сооответственно повар. солью или ацетатом натрия) и потом пропускаете сквозь смолу ваш образец и промываете смолу несколькими обьемами воды, обьединяя с образцом промывки. Все! Дело сделано большинство анионов в вашем растворе заменилось на тот, что вы заказали.
Это что безумно сложная операция?
Приготавление стандарт титра из перманганата калия с последующей его оттитровкой на мой взгляд сложнее.
Сообщение StYV » Вт ноя 08, 2005 8:25 am
Сообщение Nord » Вт ноя 08, 2005 9:12 am
Сообщение StYV » Вт ноя 08, 2005 9:23 am
Сообщение Nord » Вт ноя 08, 2005 12:22 pm
Ну, я помню, что нитрит-ионы, и кажется, нитраты при кипячении в растворе с мочевиной реагируют до азота и углекислоты.
Я не готовое решение предлагаю, а лишь путь.
Сообщение avor » Вт ноя 08, 2005 1:04 pm
Вот видите теперь более или менее становится ясным вопрос.
1) Не знаю аналитики бора. Но возможно ему нитраты и мешают. Помню только прелестную реакцию со спиртом в пламени замечательный зеленинький цвет. Кстати, может вам вместо удаления нитрата, испарить бор в виде борорганики.
2)Образцы тысячами не значит, что методика должна быть простой. Это всего лиш вопрос автоматизации. Например методика секвенирования ДНК не может быть названа простой, однако для программы «Геном человека» она была автоматизирована так, что стали возможны сотни тысячь анализов. При чем каждый последующий геном обходится дешевле первого и делается быстрее.
3) Опишите эксперимент.
4) Замена иона в ионообменнике не сравнима по простоте и возможности автоматизации с ВЭЖХ. Например, я себе представляю недорогую установку в которой легко можно обрабатывать до 400 образцов одновременно.
6) нет у меня ссылки, сам на уроке делал(давно это было), да в любом кач. анализе, что-то подобное должно быть описано.
Есть еще предложения.
а) Пркаливание с силикатами улетучивает нитраты. Потом можно выщелачивать из королька бор щелочью.
Аммиачная силитра разлагается с выделением закиси азота. Намек поняли. Нечто подобное предлагал Норд.
И поймите меня правильно, для меня поставленная вами задача также нова, как и для вас. И я думаю для любого из тех кто читает здесь наши опусы. Поэтому высказанное есть только идеи, а не решение проблемы.
А проверять вам и решать стоит проверять или нет тоже вам.
А все пространные рассуждения с самого начала были вызваны расплывчатостью заданного вопроса.
Как действовать в аварийных ситуациях, связанных с кислотами и щелочами
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги; 
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
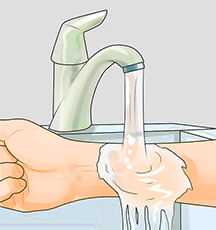
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер 
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы. Следует принять меры предосторожности, необходимые при контакте с кислотами или щелочами; использовать резиновую обувь, перчатки и респираторы, очки.
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
Как правильно гасить азотную кислоту
Пользователь
Регистрация: 04.06.2012
Откуда: Алтай
Сообщений: 121
В друзьях у: 0
Голосов: 4 / 1
ИТОГ: ничего в колбе нет даже 1грамма хотя до осаждения проверял лакмусом наличие Au показало.
Этой борматухи получилось 2 литра
В данный момент колбу поставил под вытяжку на плитку и начал всё это упаривать.
Подскажите товарищи как можно это дело исправить.
Пользователь
Регистрация: 23.09.2007
Откуда: Стольный Город
Сообщений: 243
В друзьях у: 2
Голосов: 12 / 5
Пользователь
Регистрация: 04.06.2012
Откуда: Алтай
Сообщений: 121
В друзьях у: 0
Голосов: 4 / 1
Всё выпарил, получилось почти литр киселя коричневого цвета.
ПОДСКАЖИТЕ ДРУЗЬЯ, что мне делать!?
Пользователь
Регистрация: 04.06.2012
Откуда: Алтай
Сообщений: 121
В друзьях у: 0
Голосов: 4 / 1
Пользователь
Регистрация: 18.09.2011
Сообщений: 634
В друзьях у: 3
Голосов: 24 / 0
Пользователь
Регистрация: 04.06.2012
Откуда: Алтай
Сообщений: 121
В друзьях у: 0
Голосов: 4 / 1
Пользователь
Регистрация: 06.02.2011
Сообщений: 233
В друзьях у: 1
Голосов: 14 / 0
Пользователь
Регистрация: 23.09.2007
Откуда: Стольный Город
Сообщений: 243
В друзьях у: 2
Голосов: 12 / 5
Пользователь
Регистрация: 04.06.2012
Откуда: Алтай
Сообщений: 121
В друзьях у: 0
Голосов: 4 / 1
Пользователь
Регистрация: 18.09.2011
Сообщений: 634
В друзьях у: 3
Голосов: 24 / 0
Пользователь
Регистрация: 04.06.2012
Откуда: Алтай
Сообщений: 121
В друзьях у: 0
Голосов: 4 / 1
Пользователь
Регистрация: 18.09.2011
Сообщений: 634
В друзьях у: 3
Голосов: 24 / 0
Пользователь
Регистрация: 24.03.2012
Сообщений: 7
В друзьях у: 0
Голосов: 0 / 0
Пользователь
Регистрация: 18.09.2011
Сообщений: 634
В друзьях у: 3
Голосов: 24 / 0
Пользователь
Регистрация: 15.10.2008
Откуда: Столица ювелиров
Сообщений: 540
В друзьях у: 1
Голосов: 6 / 1
1 литр ЦВ маловато для полутора кг шлама. золото в пережёнке должно быть от 8 до 16 %, отталкиваясь от этого можно сделать вывод, что реакция полностью могла не пройти..
сперва промойте свою серу, залейте её азотной кислотой,вскипятите, промойте пару раз в кипятке и плавьте. а всё остальное на повторную переработку. но что-то мне кажется процесс будет трудоёмким, ибо Вы туда закинули аж килограмм железного купороса. оочень рекомендую Вам пользоваться солянокислым гидразином, он хоть и дороже на порядок, но выдаёт более крупный осадок, особенно на горячую
Пользователь
Регистрация: 04.06.2012
Откуда: Алтай
Сообщений: 121
В друзьях у: 0
Голосов: 4 / 1
Пользователь
Регистрация: 15.10.2008
Откуда: Столица ювелиров
Сообщений: 540
В друзьях у: 1
Голосов: 6 / 1
боюсь как бы ваша повторная переработка не затянулась из-за переизбытка железного купороса.
Азотная кислота: получение и химические свойства
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
4. Азотная кислота частично разлагается при кипении или под действием света:
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Еще пример : азотная кислота окисляет иодоводород:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.





