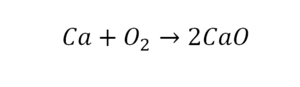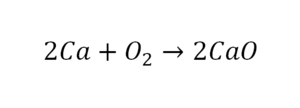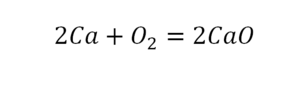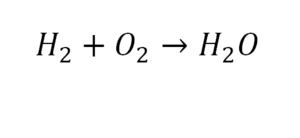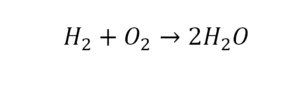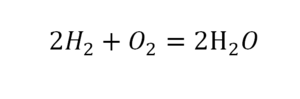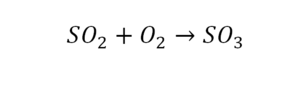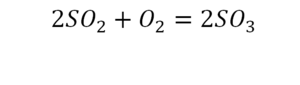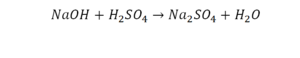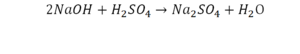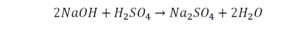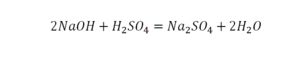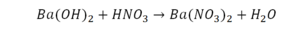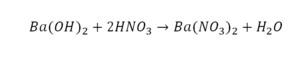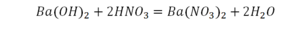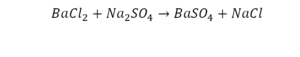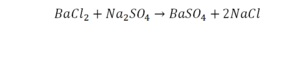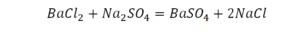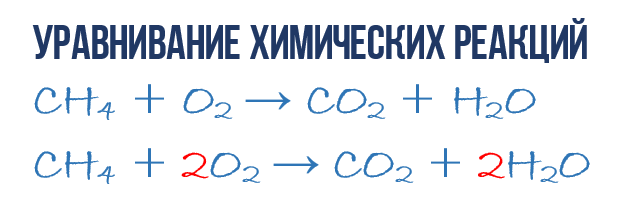Как посчитать коэффициент в химии
Как посчитать коэффициент в химии
Ключевые слова конспекта: химическая формула, индекс, коэффициент, качественный и количественный состав, формульная единица.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.

Если требуется обозначить не одну, а несколько молекул (или отдельных атомов), то перед химической формулой (или знаком) ставят соответствующую цифру, которую называют коэффициентом. Например, три молекулы воды обозначаются 3Н2О, пять атомов железа — 5Fe. Индекс 1 в химических формулах и коэффициент 1 перед химическими символами и формулами не пишут.
Запись 5Н2О (пять-аш-два-о) следует понимать так: пять молекул воды образованы десятью атомами водорода и пятью атомами кислорода.
| ЗАДАНИЕ. Обозначить, используя символы химических элементов а) три молекулы азота б) семь молекул сульфида железа в) четыре атома серы г) два атома кальция д) семь молекул воды е) четыре молекулы кислорода ж) две молекулы сернистой кислотыОТВЕТ: а) три молекулы азота — 3N2 б) семь молекул сульфида железа — 7FeS в) четыре атома серы — S4 г) два атома кальция — Ca2 д) семь молекул воды — 7H2O е) четыре молекулы кислорода — 4O2 ж) две молекулы сернистой кислоты — 2H2SO3Объяснение: коэффициенты показывают количество молекул, индексы — количество атомов. Формулы молекул простых веществ нужно запомнить. Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие. Из двухатомных молекул состоят водород H2, кислород O2, азот N2, галогены F2, Cl2, Br2, I2. Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4. |
По химической формуле мы можем дать веществу название, определить его качественный и количественный состав, а также подсчитать его относительную молекулярную массу.Химическая формула показывает, из атомов каких элементов состоит вещество (то есть качественный состав вещества); и каково соотношение атомов этих элементов (то есть количественный состав вещества).
Формульная единица
Химические формулы веществ, имеющих немолекулярное строение, например FeS, не описывают состав молекулы; а только показывают соотношение элементов, образующих данное вещество.
Так, кристаллическая решётка поваренной соли — хлорида натрия состоит не из молекул, а из ионов. На каждый положительно заряженный ион натрия в ней приходится один отрицательно заряженный ион хлора. Получается, что отношение индексов в записи NaCl совпадает с отношением; в котором химические элементы соединяются между собой, образуя вещество. По отношению к веществам, имеющим немолекулярное строение, такую запись правильнее называть не формула, а формульная единица.
В таком случае величина Мr должна называться не относительной молекулярной массой, а относительной формульной массой. Тем не менее по традиции выражение «относительная молекулярная масса» используют и по отношению к веществам немолекулярного строения.
Конспект урока «Химическая формула. Индекс и коэффициент. Формульная единица«.
Как расставлять коэффициенты в химических уравнениях
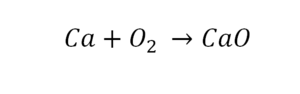
Такая запись является схемой химической реакции. Когда возникает знак «=», то это называется «уравнение». Попробуем его решить.
Пример разбора простых реакций
В кальции один атом, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. С правой стороны уравнения Са тоже один. По кальцию нам не надо работать.
Видео: Коэффициенты в уравнениях химических реакций.
Смотрим следующий элемент — кислород. Индекс 2 говорит о том, что здесь 2 иона кислорода. С правой стороны нет индексов, то есть одна частица кислорода, а с левой — 2 частицы. Что мы делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты — это то, что написано перед наименьшей частью. Они имеют право меняться. Для удобства саму формулу не переписываем. С правой части один умножаем на 2, чтобы получить и там 2 иона кислорода.
После того как мы поставили коэффициент, получилось 2 атома кальция. С левой стороны только один. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество атомов элементов равно с обеих сторон, то можем поставить знак «равно».
Другой наглядный пример: два водорода слева, и после стрелочки у нас тоже два водорода.
Смотрим дальше:
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось два атома водорода. И чтобы получить 4, мы должны водород умножить на два.
Видео: Расстановка коэффициентов в химическом уравнении
Вот тот случай, когда элемент в одной и в другой формуле с одной стороны, до стрелочки.
Один ион серы слева, и один ион — справа. Две частицы кислорода, плюс еще две частицы кислорода. Значит, что с левой стороны 4 кислорода. Справа же находится 3 кислорода. То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. Для этого умножаем на два всю формулу после стрелочки. После умножения получаем шесть ионов кислорода, да еще и 2 атома серы. Слева же имеем одну микрочастицу серы. Теперь уравняем ее. Ставим слева уравнения перед серой 2.
Уравняли.
Сложные реакции
Этот пример более сложный, так как здесь больше элементов вещества.
Это называется реакцией нейтрализации. Что здесь нужно уравнивать в первую очередь:
Напрашивается вывод, что надо умножить всю формулу на два.
Видео: Составление уравнений химических реакций
Теперь смотрим, сколько серы. С левой и правой стороны по одной. Обращаем внимание на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем 2.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны также 6 атомов. Проверяем водород. Два атома водорода и еще 2 атома водорода. То есть будет четыре атома водорода с левой стороны. И с другой стороны также четыре атома водорода. Все элементы уравнены. Ставим знак «равно».
Видео: Химические уравнения. Как составлять химические уравнения.
Здесь пример интересен тем, что появились скобки. Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Слева азот один, а справа, с учетом скобок, его два.
Справа два атома водорода, а нужно четыре. Мы выходим из положения, просто умножая воду на два, в результате чего получили четыре водорода. Отлично, водород уравняли. Остался кислород. До реакции присутствует 8 атомов, после — тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Последний пример.
На очереди у нас барий. Он уравнен, его трогать не нужно. До реакции присутствует два хлора, после нее — всего один. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Видео: Балансирование химических уравнений.
Теперь за счет коэффициента, который только что поставлен, после реакции получилось два натрия, и до реакции тоже два. Отлично, все остальное уравнено.
Также уравнивать реакции можно методом электронного баланса. Этот метод имеет ряд правил, по которым его можно осуществлять. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.
Расчёты по уравнениям химических реакций.
Стехиометрия – количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими.
Законы стехиометрии:
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими.
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
Моль – это такое количество вещества, в котором содержится определённое число частиц (молекул, атомов, ионов), равное постоянной Авогадро:
Выход реакции η – отношение реальной массы продукта mp к теоретически возможной mт, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
Схема расчёта по уравнениям химических реакций:
Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
1. Составим уравнение химической реакции:
2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам:
3. Определим молярную массу магния:
Относительная атомная масса магния Ar(Mg) = 24.
Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M(Mg) = 24 г/моль.
4. По массе вещества, заданной в условии, вычислим количество вещества:
5. Над химической формулой оксида магния MgO, масса которого неизвестна, ставим x моль, над формулой магния Mg пишем его молярную массу:
6. Составим пропорцию:
По правилам решения пропорции:
Количество оксида магния ν(MgO) = 1 моль.
Определение коэффициентов в уравнении химических реакций
Презентация к уроку
1. Помочь обучающимся сформировать знания о химическом уравнении как об условной записи химической реакции с помощью химических формул.
2. Сформулировать закон сохранения массы.
3. Закрепить понятия об уравнении химической реакции, реагентах, продуктах реакции.
5. Продолжать формировать умение составлять, уравнение химических реакции.
Тип урока: комбинированный.
Форма организации УД: Взаимопроверка, вопросно-ответный способ УД
Методы обучения: Вопросно-ответный способ УД. Взаимопроверка, объяснение сильными учениками слабым
Средства: Презентация. Проектор. Приложение. правила работы в группах, классная доска, компьютер.
Повторение ранее изученного материала.
1.Типы химических реакций
2.Что пишут с правой стороны уравнений?
3.Что пишут с левой стороны уравнений?
4.Типы химических реакций
Как мы расставили коэффициенты в простых уравнениях
Создать условия мотивации учебной деятельности; «На этом уроке каждый из вас будет иметь возможность получить несколько оценок за урок при условии активной работы
Определить цели урока; «Проведём небольшую разминку, вспомним, какие типы реакций, вы знаете?»
Актуализировать опорные знания учащихся.
Индивидуальные карточки с заданиями:
Типы химических реакций (определить)
Молодцы!
Понимать и объяснять типы химических реакций
Обобщать и воспроизводить запись реакции
На правильность выполнения задания, на правильность написания названий элементов
Учитель:
Примеры рассуждений при выполнении упражнений
Расставим коэффициенты в реакции обмена.
1.Уравниваем число атомов железа
2.Уравниваем число атомов серы
3.Уравниваем число атомов бария
4.Уравниваем число атомов водорода
5.Уравниваем число атомов кислорода
Запись в тетрадь алгоритм уравнивания реакции
Соблюдая правило Закона сохранения масс число атомов каждого химического элемента в левой части уравнения должно равняться числу атомов каждого химического элемента правой части уравнения.
Запись в тетради
Направляет на правильное рассуждение, поиска решения
Рассуждение каждого в группе Взаимопомощь.
Объяснить почему? (на основании правила ЗСМ)
Направляет на правильное рассуждение, поиска решения
Молодцы!
Обобщать и воспроизводить по алгоритму уравнение реакции, сравнивать, понимать алгоритм, закон сохранения массы вещества
2 варианта тестов
Рассуждение (в уме) действовать в соответствии с алгоритмом уравнивания реакций.
Активные действия учащихся с объемом изучения;
Чтение и закрепление
параграф 27
Литература: учебник 8 класса. Автор: О.С.Габрилян. Гимназия на дому А.Е.Савельев Дрофа 2008 Слайд 13
Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.