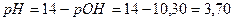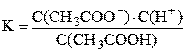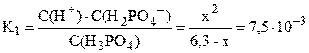Как посчитать кислотность слабой кислоты
Расчёт pH в растворах слабых (средних) кислот и оснований.
Слабые (и средние) электролиты в водных растворах диссоциируют не полностью, равновесие в этих растворах описывается с помощьюконстант диссоциации (ионизации):
 |
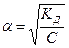 |
Расчёты рН в таком случае ведут по формулам:
Для слабой кислоты:
[Н + ]= a • Cна = 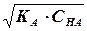 Þ рН =- lg Þ рН =- lg 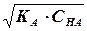 |
Для слабого основания:
Примеры решения задач по расчёту рН растворов слабых кислот и оснований.
Пример 8.Вычислить рН 0,001 Н уксусной кислоты, если 
Решение:
Пример 9.Определить:
А) рН 0,01н СН3СООН, если
В) рН 0,01н NH4OH, если
Решение: Представив уравнение 

таким образом для одноосновной кислоты
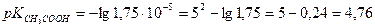


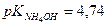
Решение:

Пример 11.Вычислить рН раствора, в 500мл которого растворено 2г NaOH.
Решение:
РН=14-рСоснов;
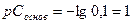
Решение.
В водном растворе аммиака имеет место равновесие
Решение.
Записывают уравнение диссоциации уксусной кислоты
Из закона разбавления Оствальда 
Задачи:
Расчет концентрации ионов и ионной силы в растворах сильных электролитов
1. Считая диссоциацию полной, вычислить концентрации ионов:
2. Вычислить ионную силу в растворах:
0,3 М хлорида бария, 0,06 М ортофосфата калия, 0,02 М сульфата алюминия.
3. Рассчитать ионную силу раствора, содержащего в 1 дм 
Ответ: (0,82; 2,45•10 
Ответ: (3,16*10 


Расчет концентрации ионов, рН и РОН в растворах слабых электролитов:
7. Вычислить рН 0,01н раствора гидроокиси аммония, степень диссоциации которой равна 0,1.
8. Активная кислотность желудочного сока равна 0,047. Найти рН желудочного сока.
10.Вычислить рН раствора азотной кислоты, если массовая доля кислоты в растворе равна 4% ( 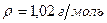
11.Вычислить концентрацию и число ионов водорода в крови объёмом 100мл,если рН крови=7,36.
14.Вычислить рН и рОН 0,001 моль/дм 3 раствора хлороводородной кислоты с учётом ионной силы раствора.
15.Сколько граммов гидроксида натрия потребуется для приготовления 500 см 
16.Вычислить рН 0,02 моль/дм 3 раствора серной кислоты, считая её диссоциацию на ионы полной. (Ответ: 1,40)
17 Рассчитать рН раствора гидроксида калия с массовой долей 0,19%. (12,53)
18 Вычислить активность гидроксид-ионов и ран + в 0,01 моль/дм 3 растворе гидроксида калия. (Ответ: 9*10 моль/дм 3 ; 11,95)
19 Вычислить концентрации ионов водорода и гидроксид-ионов в растворе хлороводородной кислоты при рН 4.
(Ответ: 10 моль/дм 3 ;10 моль/дм 3 )
20 Рассчитать рН 0,60%-ного раствора уксусной кислоты. (Ответ: 2,38)
21 Вычислить рН 0,1 моль/дм 

23 Вычислить рН 10%-ного раствора аммиака. Ответ: (11,71)
Калькулятор pH раствора
Калькуляторы ниже предназначены для решения химических задач. Или, если угодно, для проверки ответов. Первый калькулятор рассчитывает pH раствора сильной кислоты или сильного основания по заданным формуле вещества и молярности раствора. Второй калькулятор рассчитывает pH раствора слабой кислоты или слабого основания по заданным константе диссоциации и молярности раствора. Описание расчета с некоторой теорией можно найти под калькуляторами.
Расчет pH в растворах сильных кислот и оснований
Расчет pH в растворах слабых кислот и оснований
pH раствора
pH является мерой кислотности водных растворов. Однако, в большинстве задач на растворы для описания раствора обычно используется молярная концентрация раствора или молярность. Как связаны эти две величины?
Активность ионов, конечно, зависит от их концентрации и эта зависимость описывается следующим уравнением:
где,
– активность ионов водорода
– коэффициент активности ионов водорода
– концентрация ионов водорода
Коэффициент активности является функцией от концентрации ионов и стремится к 1 по мере разбавления раствора. При этом для идеальных растворов концентрации ионов равны концентрации растворенного вещества с учетом коэффициентов в формуле соединения. Поэтому для большинства задач, предполагающих идеальные растворы, можно использовать логарифм по основанию 10 от молярной концентрации раствора.
То, как проявляет себя водный раствор, как кислота или как основание, зависит от количества ионов водорода (H+). Вода, сама по себе, содержит некоторое количество ионов водорода 1 благодаря явлению автодиссоциации:
Расчет показателя pH по молярной концентрации раствора отличается в случаях сильных и слабых кислот и оснований.
Сильная кислота / Сильное основание
Для растворов оснований известна концентрация основания, то есть, концентрация гидроксид ионов OH-. Следовательно можно рассчитать pOH:
Таким образом, для оснований:
Всего семь кислот считаются сильными:
Сильных оснований не намного больше, и не все из них растворимы в воде. К растворимым относятся:
Раствор сильной кислоты с концентрацией 1 M (1 моль/литр) имеет pH равный 0. Раствор сильного основания с концентрацией 1 M (1 моль/литр) имеет pH равный 14. В большинстве задач значения pH будут лежать в границах от 0 до 14, однако отрицательные значения pH, также как и значения pH больше 14 вполне возможны.
Слабая кислота / слабое основание
Формула константы диссоциации кислоты Ka:
где:
– концентрация ионов H+
– концентрация анионов
– концентрация недиссоциированного соединения
для реакции
Эта формула описывает состояние равновесия. Чтобы найти H+, составим следующую таблицу изменения концентрации. В таблице обозначим искомую концентрацию H+ как x:
| HB | H+ | B- | |
|---|---|---|---|
| Начальная концентрация | C M | 0 M | 0 M |
| Изменение концентрации | -x M | +x M | +x M |
| Концентрация в состоянии равновесия | (C-x) M | x M | x M |
Используем эти величины в формуле для Ka:
Получим квадратное уравнение:
Решаем его, выбрав положительный корень. После чего найденное значение можно подставить в формулу pH.
Тот же самый способ применим и к растворам оснований, только используется константа диссоциации основания и сначала рассчитывается pOH.
Обычно константы диссоциации даны в условии задачи, либо их можно посмотреть в таблице для известных соединений.
Стоит заметить, что в таблицах для некоторых кислот указывается несколько значений Ka. Это многоосновные кислоты, которые могут отдать в раствор более чем один протон. Однако, из-за молекулярных сил, значение Ka для каждого следующего протона уменьшается на несколько порядков.
Например, для фосфорной кислоты:
Поэтому в задачах обычно рассматривается отдача только одного протона, и для всех вычислений можно использовать стохиометрический коэффициент равный 1.
Строго говоря ион водорода недолго пребывает в виде свободного протона, так как он быстро гидратируется молекулой воды. В результате образуется ион гидроксония ↩
РАСЧЁТ pH В РАСТВОРАХ КИСЛОТ И ОСНОВАНИЙ
Растворы, в которых концентрации ионов H + и OH – одинаковы, называются нейтральными растворами. В нейтральном растворе C(H + ) = C(OH – ) = 10 –7 моль/л.
В кислом растворе C(H + ) > C(OH – ) и, как следует из уравнения ионного произведения воды, C(H + ) > 10 –7 моль/л, а C(OH – ) –7 моль/л.
В щелочном растворе C(OH – ) > C(H + ); при этом в C(OH – ) > 10 –7 моль/л, а C(H + ) –7 моль/л.
pH – величина, с помощью которой характеризуют кислотность или щёлочность водных растворов; эта величина называется водородным показателем и рассчитывается по формуле:
В кислом растворе pH 7.
По аналогии с понятием «водородный показатель» (pH) вводится понятие «гидроксильный» показатель (pOH):
Водородный и гидроксильный показатели связаны соотношением
Гидроксильный показатель используется для расчёта pH в щелочных растворах.
Пример 7.1 Рассчитать pH 0,005 М раствора серной кислоты.
pH = –lg C(H + ) = –lg 0,01 = 2.
Пример 7.2 Рассчитать pH 0,1 М раствора гидроксида натрия.
pOH = –lg C(H + ) = –lg 0,1 = 1; pH = 14 – pOH = 14 – 1 = 13.
Диссоциация слабого электролита – это равновесный процесс. Константа равновесия, записанная для процесса диссоциации слабого электролита, называется константой диссоциации. Например, для процесса диссоциации уксусной кислоты
Каждая стадия диссоциации многоосновной кислоты характеризуется своей константой диссоциации. Константа диссоциации – справочная величина; см. [1; 2].
Расчёт концентраций ионов (и pH) в растворах слабых электролитов сводится к решению задачи на химическое равновесие для того случая, когда известна константа равновесия и необходимо найти равновесные концентрации веществ, участвующих в реакции (см. пример 6.2 – задача 2 типа).
Пример 7.3 Рассчитать pH и степень диссоциации электролита в растворе NH4OH с массовой долей 0,35%. Плотность раствора – 1 г/мл.
В 0,35% растворе NH4OH молярная концентрация гидроксида аммония равна 0,1 моль/л (пример перевода процентной концентрации в молярную – см. пример 5.1). Эту величину часто обозначают C0. C0 – это общая концентрация электролита в растворе (концентрация электролита до диссоциации).
Подставляем выраженные через x равновесные концентрации всех частиц в уравнение константы диссоциации:
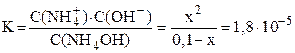
Очень слабые электролиты диссоциируют незначительно (x ® 0) и иксом в знаменателе как слагаемым можно пренебречь:
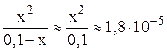
Обычно в задачах общей химии иксом в знаменателе пренебрегают в том случае, если 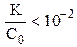
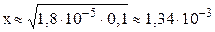
pH = 14 – pOH = 14 – 2,87 = 11,13.
Степень диссоциации электролита можно рассчитать как отношение концентрации продиссоциировавшего электролита (x) к общей концентрации электролита (C0):
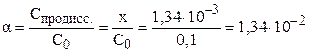
Пример 7.4 Рассчитать pH 30% раствора фосфорной кислоты (плотность раствора 1,18 г/мл. Чему равна степень диссоциации электролита в этом растворе?
Сначала следует перевести процентную концентрацию в молярную (см. пример 5.1). В данном случае C0(H3PO4) = 3,6 моль/л.
Пусть фосфорной кислоты продиссоциировало по первой стадии x моль/л, тогда из уравнения диссоциации H3PO4 ⇆ H + + H2PO4 – следует, что равновесные концентрации ионов H + и H2PO4 – также будут равны x моль/л, а равновесная концентрация непродиссоциировавшей H3PO4 будет равна (3,6–x) моль/л. Подставляем выраженные через x концентрации ионов H + и H2PO4 – и молекул H3PO4 в выражение константы диссоциации по первой стадии (K1 = 7,5·10 –3 – справочная величина):
K1/C0 = 7,5·10 –3 / 3,6 = 2,1·10 –3 –2 ; следовательно, иксом как слагаемым в знаменателе можно пренебречь (см. также пример 7.3) и упростить полученное выражение.
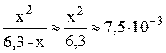
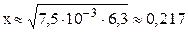
С(H + ) = x = 0,217 моль/л; pH = –lg C(H + ) = –lg 0,217 = 0,66.
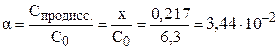
Задание №8
Рассчитайте а) pH растворов сильных кислот и оснований; б) раствора слабого электролита и степень диссоциации электролита в этом растворе (таблица 8). Плотность растворов принять равной 1 г/мл.
Таблица 8 – Условия задания №8
| № вари- анта | а | б | № вари- анта | а | б |
| 0,01М H2SO4; 1% NaOH | 0,35% NH4OH | ||||
| 0,01МCa(OH)2; 2%HNO3 | 1% CH3COOH | 0,04М H2SO4; 4% NaOH | 1% NH4OH | ||
| 0,5М HClO4; 1% Ba(OH)2 | 0,98% H3PO4 | 0,7М HClO4; 4%Ba(OH)2 | 3% H3PO4 | ||
| 0,02M LiOH; 0,3% HNO3 | 0,34% H2S | 0,06M LiOH; 0,1% HNO3 | 1,36% H2S | ||
| 0,1М HMnO4; 0,1% KOH | 0,031% H2CO3 | 0,2М HMnO4; 0,2%KOH | 0,124%H2CO3 | ||
| 0,4М HCl; 0,08%Ca(OH)2 | 0,47% HNO2 | 0,8МHCl; 0,03%Ca(OH)2 | 1,4% HNO2 | ||
| 0,05M NaOH; 0,81% HBr | 0,4% H2SO3 | 0,07M NaOH; 3,24% HBr | 1,23% H2SO3 | ||
| 0,02M Ba(OH)2; 0,13%HI | 0,2% HF | 0,05M Ba(OH)2; 2,5% HI | 2% HF | ||
| 0,02М H2SO4; 2% NaOH | 0,7% NH4OH | 0,06МH2SO4; 0,8%NaOH | 5%CH3COOH | ||
| 0,7М HClO4; 2%Ba(OH)2 | 1,96% H3PO4 | 0,08М H2SO4; 3% NaOH | 4% H3PO4 | ||
| 0,04MLiOH; 0,63%HNO3 | 0,68% H2S | 0,008M HI; 1,7%Ba(OH)2 | 3,4% H2S | ||
| 0,3МHMnO4; 0,56%KOH | 0,062% H2CO3 | 0,08M LiOH; 1,3% HNO3 | 0,2% H2CO3 | ||
| 0,6М HCl; 0,05%Ca(OH)2 | 0,94% HNO2 | 0,01M HMnO4; 1% KOH | 2,35% HNO2 | ||
| 0,03M NaOH; 1,62% HBr | 0,82% H2SO3 | 0,9МHCl; 0,01%Ca(OH)2 | 2% H2SO3 | ||
| 0,03M Ba(OH)2; 1,26%HI | 0,5% HF | 0,09M NaOH; 6,5% HBr | 5% HF | ||
| 0,03М H2SO4; 0,4%NaOH | 3% CH3COOH | 0,1M Ba(OH)2; 6,4% HI | 6%CH3COOH | ||
| 0,002M HI; 3% Ba(OH)2 | 1% HF | 0,04МH2SO4; 1,6%NaOH | 3,5% NH4OH | ||
| 0,005МHBr; 0,24% LiOH | 1,64% H2SO3 | 0,001М HI; 0,4%Ba(OH)2 | 5% H3PO4 |
Пример 7.5 Смешали 200 мл 0,2М раствора H2SO4 и 300 мл 0,1М раствора NaOH. Рассчитайте pH образовавшегося раствора и концентрации ионов Na + и SO4 2– в этом растворе.
Из ионно-молекулярного уравнения реакции следует, что в реакцию вступают только ионы H + и OH – и образуют молекулу воды. Ионы Na + и SO4 2– в реакции не участвуют, поэтому их количество после реакции такое же как и до реакции.
Расчёт количеств веществ до реакции:
n(H + ) = 2 × n(H2SO4) = 2 × 0,02 моль = 0,04 моль;
n(NaOH) = 0,1 моль/л · 0,3 л = 0,03 моль = n(Na + ) = n(OH – ).
Расчёт количеств ионов после реакции:
n(H + ) = n(H + )до реакции – n(H + )прореагировавших = 0,04 моль – 0,03 моль = 0,01 моль;
n(Na + ) = 0,03 моль; n(SO4 2– ) = 0,02 моль.
Т.к. смешиваются разбавленные растворы, то
Vобщ. » Vраствора H2SO4 + V раствора NaOH » 200 мл + 300 мл = 500 мл = 0,5 л.
C(Na + ) = n(Na + ) / Vобщ. = 0,03 моль : 0,5 л = 0,06 моль/л;
C(H + ) = n(H + ) / Vобщ. = 0,01 моль : 0,5 л = 0,02 моль/л;
pH = –lg C(H + ) = –lg 2·10 –2 = 1,699.
Задание №9
Рассчитайте pH и молярные концентрации катионов металла и анионов кислотного остатка в растворе, образовавшемся в результате смешивания раствора сильной кислоты с раствором щёлочи (таблица 9).
Таблица 9 – Условия задания №9
| № вари- анта | Объёмы и состав растворов кислоты и щёлочи | № вари- анта | Объёмы и состав растворов кислоты и щёлочи |
| 300 мл 0,1М NaOH и 200 мл 0,2М H2SO4 | |||
| 2 л 0,05М Ca(OH)2 и 300 мл 0,2М HNO3 | 0,5 л 0,1М KOH и 200 мл 0,25М H2SO4 | ||
| 700 мл 0,1М KOH и 300 мл 0,1М H2SO4 | 1 л 0,05М Ba(OH)2 и 200 мл 0,8М HCl | ||
| 80 мл 0,15М KOH и 20 мл 0,2М H2SO4 | 400мл 0,05М NaOH и 600мл 0,02М H2SO4 | ||
| 100 мл 0,1М Ba(OH)2 и 20 мл 0,5М HCl | 250 мл 0,4М KOH и 250 мл 0,1М H2SO4 | ||
| 700мл 0,05М NaOH и 300мл 0,1М H2SO4 | 200мл 0,05М Ca(OH)2 и 200мл 0,04М HCl | ||
| 50 мл 0,2М Ba(OH)2 и 150 мл 0,1М HCl | 150мл 0,08М NaOH и 350мл 0,02М H2SO4 | ||
| 900мл 0,01М KOH и 100мл 0,05М H2SO4 | 600мл 0,01М Ca(OH)2 и 150мл 0,12М HCl | ||
| 250 мл 0,1М NaOH и 150 мл 0,1М H2SO4 | 100 мл 0,2М Ba(OH)2 и 50 мл 1М HCl | ||
| 1 л 0,05М Ca(OH)2 и 500 мл 0,1М HNO3 | 100 мл 0,5М NaOH и 100 мл 0,4М H2SO4 | ||
| 100 мл 1М NaOH и 1900 мл 0,1М H2SO4 | 25 мл 0,1М KOH и 75 мл 0,01М H2SO4 | ||
| 300 мл 0,1М Ba(OH)2 и 200 мл 0,2М HCl | 100мл 0,02М Ba(OH)2 и 150мл 0,04 М HI | ||
| 200 мл 0,05М KOH и 50 мл 0,2М H2SO4 | 1 л 0,01М Ca(OH)2 и 500 мл 0,05М HNO3 | ||
| 500мл 0,05М Ba(OH)2 и 500мл 0,15М HI | 250мл 0,04М Ba(OH)2 и 500мл 0,1М HCl | ||
| 1 л 0,1М KOH и 2 л 0,05М H2SO4 | 500 мл 1М NaOH и 1500 мл 0,1М H2SO4 | ||
| 250мл 0,4М Ba(OH)2 и 250мл 0,4М HNO3 | 200 мл 0,1М Ba(OH)2 и 300 мл 0,2М HCl | ||
| 80 мл 0,05М KOH и 20 мл 0,2М H2SO4 | 50 мл 0,2М KOH и 200 мл 0,05М H2SO4 | ||
| 300 мл 0,25М Ba(OH)2 и 200 мл 0,3М HCl | 1 л 0,03М Ca(OH)2 и 500 мл 0,1М HNO3 |
ГИДРОЛИЗ СОЛЕЙ
Таким образом, в растворе соли, гидролизующейся по аниону, появляется избыток ионов OH – (реакция среды – щелочная; pH > 7).
Таким образом, гидролизу (т.е. разложению водой) подвергаются соли, образованные:
– катионом сильного основания и анионом слабой кислоты (KNO2, Na2CO3, K3PO4);
– катионом слабого основания и анионом сильной кислоты (NH4NO3, AlCl3, ZnSO4);
– катионом слабого основания и анионом слабой кислоты (Mg(CH3COO)2, NH4F).
C молекулами воды взаимодействуют катионы слабых оснований или (и) анионы слабых кислот; соли образованные катионами сильных оснований и анионами сильных кислот гидролизу не подвергаются.
Гидролиз солей, образованных многозарядными катионами и анионами, протекает ступенчато; ниже на конкретных примерах показана последовательность рассуждений, которой рекомендуется придерживаться при составлении уравнений гидролиза таких солей.
 |
2. Если гидроксид аммония считать сильным основанием, то в растворах солей аммония, образованных слабыми кислотами, например, NH4F следует рассматривать равновесие NH4 + + F – ⇆ NH3 + HF, в котором происходит конкуренция за ион H + между молекулами аммиака и анионами слабой кислоты.
Пример 8.1 Запишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза карбоната натрия. Укажите pH раствора (pH>7, pH + + CO3 2–
2. Соль образована катионами (Na + ) сильного основания NaOH и анионом (CO3 2– ) слабой кислоты H2CO3. Следовательно, соль гидролизуется по аниону:
Гидролиз в большинстве случаев протекает обратимо (знак ⇄); на 1 ион, участвующий в процессе гидролиза, записывается 1 молекула HOH.
Это ионно-молекулярное уравнение первой стадии гидролиза Na2CO3.
5. В результате гидролиза по первой стадии образовались гидрокарбонат ионы, которые участвуют во второй стадии гидролиза:
В результате этих рассуждений получаем следующие уравнения гидролиза:
Пример 8.2 Запишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза сульфата алюминия. Укажите pH раствора (pH>7, pH 3+ + 3SO4 2–
Это ионно-молекулярное уравнение первой стадии гидролиза Al2(SO4)3.
AlOH 2+ + HOH ⇆ Al(OH)2 + + H +
В результате этих рассуждений получаем следующие уравнения гидролиза:
Пример 8.3 Запишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза ортофосфата аммония. Укажите pH раствора (pH>7, pH + + PO4 3–
2. Соль образована катионами (NH4 + ) слабого основания NH4OH и анионами
Это ионно-молекулярное уравнение первой стадии гидролиза (NH4)3PO4.
8. Уравнение третьей стадии гидролиза в молекулярном виде, можно получить, связав присутствующие в уравнении NH4 + + H2PO4 – + HOH ⇆ NH4OH + H3PO4 анионы H2PO4 – и катионами NH4 + и образовав соль NH4H2PO4:
В результате этих рассуждений получаем следующие уравнения гидролиза:
Процесс гидролиза протекает преимущественно по первой стадии, поэтому реакция среды в растворе соли, гидролизующейся и по катиону, и по аниону определяется тем, какой из малодиссоциирующих электролитов, образующихся на первой стадии гидролиза, является более сильным. В рассматриваемом случае
реакция среды будет щелочной (pH>7), поскольку ион HPO4 2– – более слабый электролит, чем NH4OH: KNH4OH = 1,8·10 –5 > KHPO4 2– = KIII H3PO4 = 1,3×10 –12 (диссоциация иона HPO4 2– – это диссоциация H3PO4 по третьей стадии, поэтому KHPO4 2– = KIII H3PO4).
Задание №10
Запишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза солей (таблица 10). Укажите pH раствора (pH>7, pH
Что способствует осуществлению желаний? Стопроцентная, непоколебимая уверенность в своем.
Что делает отдел по эксплуатации и сопровождению ИС? Отвечает за сохранность данных (расписания копирования, копирование и пр.).
Что вызывает тренды на фондовых и товарных рынках Объяснение теории грузового поезда Первые 17 лет моих рыночных исследований сводились к попыткам вычислить, когда этот.
Конфликты в семейной жизни. Как это изменить? Редкий брак и взаимоотношения существуют без конфликтов и напряженности. Через это проходят все.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте: