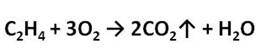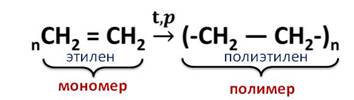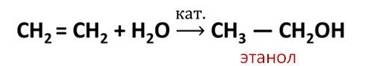с чем взаимодействует этилен
Этилен (этен), получение, свойства, химические реакции
Этилен (этен), получение, свойства, химические реакции.
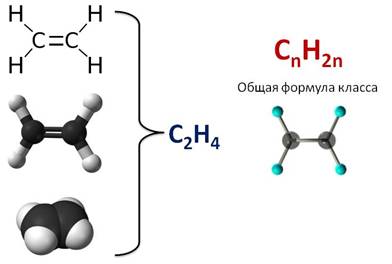
Этилен (этен), C2H4 – органическое вещество класса алкенов. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Этилен (этен), формула, газ, характеристики:
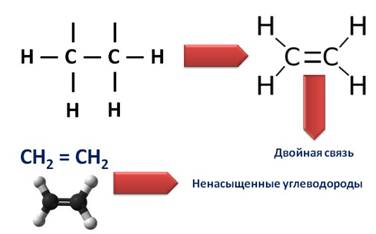
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции. Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов ), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства этилена (этена):
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства этилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
Однако при нагревании этилена до температуры 300 o C разрыва двойной углерод-углеродной связи не происходит – реакция галогенирования протекает по механизму радикального замещения:
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется этанол.
Этилен легко окисляется. В зависимости от условий проведения реакции окисления этилена могут быть получены различные вещества: многоатомные спирты, эпоксиды или альдегиды.
В результате образуется эпоксид.
В результате образуется ацетальдегид.
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
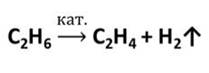
В промышленных масштабах этилен получается в результате следующей химической реакции:
Этилен в лабораторных условиях получается в результате следующих химических реакций:
Применение и использование этилена (этена):
Примечание: © Фото //www.pexels.com, //pixabay.com
как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена
напишите уравнение реакций этилен
Алкены. Химические свойства этилена
Урок 31. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Алкены. Химические свойства этилена»
Алкены. Химические свойства этилена
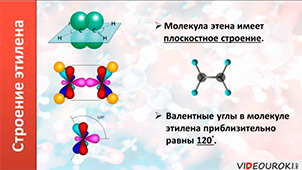
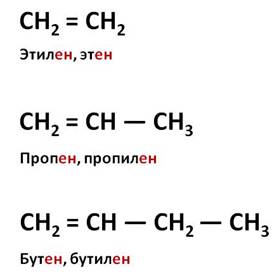
Первым представителем алкенов является этилен, или этен. Его молекулярная формула С2Н4. Из этой формулы можно выразить общую формулу этого класса – CnH2n.
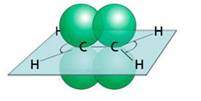
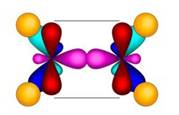
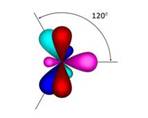
В образовании молекулы этилена участвуют два атома углерода, с каждым атомом углерода соединено два атома водорода и ещё у каждого атома углерода остаётся по одной свободной валентности, ведь атомы углерода должны быть четырёхвалентны. Поэтому между этими двумя углеродами возникает ещё одна связь. Такую связь называют двойной.
Из-за этой двойной связи этилен относят к ненасыщенным углеводородам, потому что атомы углерода не насыщены до предела атомами водорода, а образуется двойная C – C связь.
Вторым представителем гомологического ряда алкенов является пропен, или пропилен. Как вы могли заметить, в названии свех алкенов употребляется суффикс – ен. Следующим представителем алкенов является бутен, или бутилен.
По физическим свойствам этилен – газ со слабым запахом, незначительно растворяется в воде, лучше – в органических растворителях.
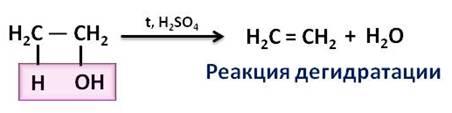
В лаборатории этилен можно получить из этилового спирта, путём отщепления от него молекулы воды. Эта реакция протекает в присутствии серной кислоты и при нагревании.
Эта реакция является реакцией дэгидратации. То есть, реакции дэгидратации – это реакции разложения, в результате которых от молекул веществ отщепляется вода.
Если поджечь выделяющийся газ, то можно заметить, что этилен горит светящимся пламенем.
Этилен применяют для получения пластмасс и полиэтилена.
Полиэтилен – распространённый материал, из которого изготавливают трубы, посуду, его используют как покрытие для теплиц, как упаковку для сельхозпродуктов и продуктов питания, изготовления одноразовой посуды. Этилен используют для получения этилового спирта и других растворителей.
Полиэтилен получают из этилена при высокой температуре и давлении.
Эта реакция называется реакцией полимеризации. То есть, реакции полимеризации – это реакции, в которых происходит соединение молекул исходного вещества в огромную молекулу.
Исходное вещество, которое вступает в реакцию полимеризации, называется мономером. В данном случае, это – этилен, а продукт реакции – это полимер, у нас это – полиэтилен.
Полимеризацию можно рассматривать как частный случай реакции присоединения.
Для алкенов характерны и другие реакции присоединения. Эти реакции протекают с разрывом одной из двух связей.
Например, реакция присоединения воды, которая называется реакцией гидратации.
В результате реакции гидратации этилена образуется спирт – этанол. Эта реакция протекает в присутствии катализатора.
Этанол, или этиловый спирт широко используется как растворитель, для производства каучуков, пластмасс и химических волокон.
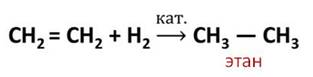
Водород присоединяется к этилену в присутствии катализатора с образованием этана. В этой реакции разорвалась одна химическая связь в молекуле этилена и связь в молекуле водорода и образовались две новые связи Н – С в молекуле этана.
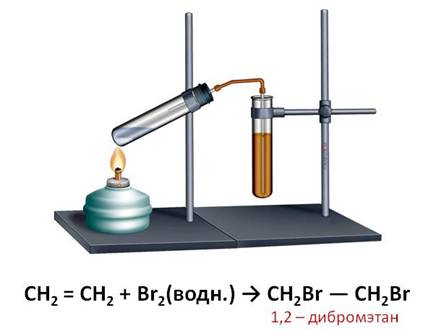
С помощью реакций присоединения можно распознать алкены. Качественными реакциями на двойную связь являются реакции обесцвечивания ими бромной воды и водного раствора перманганата калия.
Например, если пропустить через раствор бромной воды этилен, то происходит обесцвечивание бромной воды. В результате данной реакции образуется соединение – 1,2 – дибромэтан – вещество, у которого отсутствуют кратные связи.
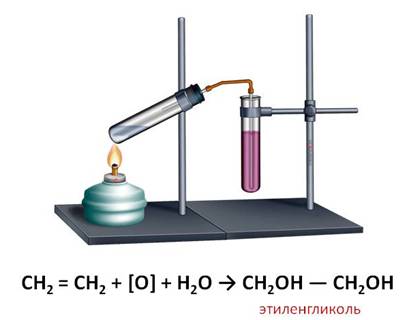
Если пропустить газ этилен через раствор марганцовки, то в данном случае, также происходит обесцвечивание этого раствора. В результате данной реакции образуется этиленгликоль.
Этилен — структурная формула, химические свойства, применение
В данной статье мы расскажем вам о многочисленных химических свойствах такого органического вещества, как этилен. Во всех подробностях разберем химические реакции с этим веществом. Помимо химических свойств обязательно рассмотрим и общее строение этилена, а также применение данного алкена, основанное на его качествах и способностях.
Характеристики этилена
Этилен, или этен, имеет структурную формулу C2 H4 и является простейшим представителем непредельных этиленовых углеводородов:

В обычных условиях данное органическое вещество является газом без цвета и запаха. А теперь можем перейти к главной теме — химическим свойствам этилена.
Главные химические свойства C2 H4
Изучение химических способностей этена будет разделено на отдельные блоки, в которых четко и детально будут расписаны подробности взаимодействий.
Реакции присоединения
Если для предельных органических соединений характерны реакции замещения, то для алкенов, в частности этилена, типичны реакции присоединения:

Реакция полимеризации
Полимеризация — это процесс соединения одинаковых простых молекул — мономеров, в более сложные — полимеры. Берется неограниченное количество молекул этилена, и при повышенных давлении и температуре, в присутствии катализатора образуется полиэтилен.
Важно! Обратите внимание, что в полиэтилене уже нет кратной связи, она разрывается в процессе реакции.
Реакции окисления
Реакция изомеризации
Данная реакция не может протекать с этиленом, потому что у него не существует изомеров.
Механизм реакции электрофильного замещения
Мы уже рассмотрели реакцию присоединения галогена к этилену. Но стоит отдельно рассказать о механизме данной реакции, который необходимо знать. В результате отталкивания от пи-связи этена в молекуле хлора происходит поляризация, благодаря которой один атом хлора становится частично положительно заряженным, а другой — частично отрицательно заряженным. Это приводит к смещению пи-связи и образованию пи-комплекса.

Применение этилена
Почему мы выделяем этот вопрос при изучении химических свойств этилена? Потому что применение данного органического вещества основано на всех его химических свойствах:
Благодаря этой статье, вы изучили и подробно рассмотрели все химические реакции, которые характерны для этилена — простейшего представителя алкенов. Перед этим кратко узнали о строении этого органического соединения, что позволило более четко взглянуть на его химическую активность в различных взаимодействиях. Мы оценили важность и пользу этена, а также его необходимость в современной жизни человека. Чтобы закрепить изученный материал, рекомендуем вам пройти тест, расположенный ниже и посмотреть познавательное видео.
Этилен, этен
В природе этот газ практически не встречается: он образуется в незначительных количествах в тканях растений и животных как промежуточный продукт обмена веществ. Попутно это — самое производимое органическое соединение в мире. Газ этилен служит сырьем для получения полиэтилена.
Свойства этилена
Этилен (другое название — этен ) — химическое соединение, описываемое формулой С2H4. В природе этилен практически не встречается. Это бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен является простейшим алкеном (олефином). Содержит двойную связь и поэтому относится к ненасыщенным соединениям. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном.
Сырье для полиэтилена и не только
Этилен — самое производимое органическое соединение в мире; общее мировое производство этилена в 2005 году составило 107 миллионов тонн и продолжает расти на 4–6% в год. Источником промышленного получения этилена является пиролиз различного углеводородного сырья, например, этана, пропана, бутана, содержащихся в попутных газах нефтедобычи; из жидких углеводородов — низкооктановые фракции прямой перегонки нефти. Выход этилена – около 30%. Одновременно образуется пропилен и ряд жидких продуктов (в том числе ароматических углеводородов).
Применение
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза. Основное направление использования этилена — в качестве мономера при получении полиэтилена (наиболее крупнотоннажный полимер в мировом производстве). В зависимости от условий полимеризации получают полиэтилены низкого давления и полиэтилены высокого давления.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
Химические свойства алкенов
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
| Например, при гидрировании бутена-2 образуется бутан. |
| Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление. |
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан. |
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
| Например, при взаимодействии этилена с бромоводородом образуется бромэтан. |
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. |
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен. |
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
| Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида) |
| Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида |
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
| Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия: |
| Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон: |
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
| Например, уравнение сгорания пропилена: |
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
| Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1 |
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.